目前,鐵是使用最廣泛的金屬,同學們對生活中的鐵制品展開了項目化學習的探究。
任務一:尋找生活中廢舊鐵制品的一些處理方法。
(1)方法1:丟棄。結合圖,生銹的廢舊鐵制包裝盒屬于 aa(填寫序號)。

(2)方法2:除銹翻新。除鐵銹常用加入稀鹽酸的方法,但是如果稀鹽酸過量還會腐蝕金屬鐵,寫出鐵與稀鹽酸反應的化學方程式 Fe+2HCl═FeCl2+H2↑Fe+2HCl═FeCl2+H2↑,反應的現(xiàn)象是 有氣泡產(chǎn)生有氣泡產(chǎn)生。
任務二:實驗探究鐵生銹的條件及影響因素
實驗1:如圖所示進行實驗1,一段時間后觀察到C中鐵釘生銹,AB中鐵釘無明顯變化。
實驗2:為進一步探究影響鐵生銹速率的因素,小組同學設計如圖所示實驗2,利用傳感器監(jiān)測該過程中氧氣濃度的變化來判斷鐵生銹的情況。實驗記錄如表:
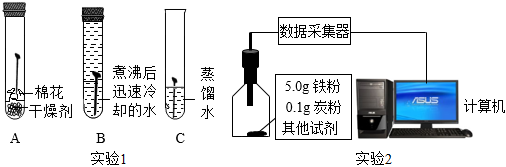
| 序號 | 其他試劑 | 初始時氧氣濃度/% | 200s時氧氣濃度/% | ||
| 水/滴 | 食鹽質量/g | 稀醋酸/滴 | |||
| ① | 0 | 0 | 0 | 20.8 | 20.8 |
| ② | 10 | 0 | 0 | 20.8 | 15.2 |
| ③ | 10 | 0 | 5 | 20.8 | 12.7 |
| ④ | 10 | 1.0 | 0 | 20.8 | 8.0 |
(3)由實驗1能得出“與水接觸是鐵生銹的條件之一”的結論,依據(jù)的現(xiàn)象是
試管A中鐵釘不生銹,試管C中鐵釘生銹
試管A中鐵釘不生銹,試管C中鐵釘生銹
。(4)實驗2的①中200s時氧氣濃度沒有發(fā)生變化的原因是
鐵粉沒有與水接觸,不能生銹
鐵粉沒有與水接觸,不能生銹
。(5)由實驗2得出“食鹽能加速鐵生銹”的結論,依據(jù)的實驗是
②④
②④
(填序號)。(6)實驗2中,設計②③的目的是
探究稀醋酸能否加速鐵生銹
探究稀醋酸能否加速鐵生銹
。任務三:了解防止鐵生銹的方法
【實踐積累】
(7)同學們通過實際觀察、查閱資料,了解了自行車常用的防銹方法。請選擇你知道的自行車構件(支架、鏈條、輪圈、車把等),說明其防銹方法:
鏈條可涂油防銹,支架刷漆等
鏈條可涂油防銹,支架刷漆等
(至少寫兩種方法)。【答案】a;Fe+2HCl═FeCl2+H2↑;有氣泡產(chǎn)生;試管A中鐵釘不生銹,試管C中鐵釘生銹;鐵粉沒有與水接觸,不能生銹;②④;探究稀醋酸能否加速鐵生銹;鏈條可涂油防銹,支架刷漆等
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:68引用:1難度:0.5
相似題
-
 1.在進行“二氧化碳制取和性質實驗”時,小明發(fā)現(xiàn)放置小蠟燭的銅架上出現(xiàn)了綠色物質,且綠色物質只出現(xiàn)在下部(伸到燒杯下面的部分),上部和在燒杯外的部分沒有出現(xiàn),小明思考,銅也會生銹嗎?為什么只出現(xiàn)在下部呢?銅生銹的條件是什么?
1.在進行“二氧化碳制取和性質實驗”時,小明發(fā)現(xiàn)放置小蠟燭的銅架上出現(xiàn)了綠色物質,且綠色物質只出現(xiàn)在下部(伸到燒杯下面的部分),上部和在燒杯外的部分沒有出現(xiàn),小明思考,銅也會生銹嗎?為什么只出現(xiàn)在下部呢?銅生銹的條件是什么?
【查閱資料】銅在一定條件下會銹蝕生成一種綠色的物質(銅綠),其主要成分是堿式碳酸銅,化學式時候Cu2(OH)2CO3,受熱易分解.
【猜想與假設】依據(jù)銅綠的化學式,小明猜想銅生銹的條件可能是,銅與氧氣、共同作用,做出此猜想的依據(jù)是.
【設計實驗】將四塊銅片分別按如圖放置半個月,觀察現(xiàn)象如下,A中銅片生銹且水面附近銹蝕最嚴重,B、C、D中銅片不生銹,D裝置中氫氧化鈉溶液的作用是,寫出該反應的化學方程式.
【得出結論】根據(jù)A和D中的實驗現(xiàn)象可知銅生銹需要.
【反思與應用】利用所得結論填空,依據(jù)本實驗結合“二氧化碳澆滅蠟燭”的實驗操作推測銅架下部容易生銹的原因是.
【實驗拓展】有資料顯示,氧化銅也能加快過氧化氫溶液的分解速率.
(1)給你一支已經(jīng)產(chǎn)生銅綠的銅架,5%過氧化氫溶液,請你設計實驗證明(儀器自選).
(2)請你試著寫出銅生成銅綠的化學方程式.發(fā)布:2024/11/10 8:0:1組卷:54引用:1難度:0.3 -
2.化學小組對鋼鐵的銹蝕進行實驗研究。
Ⅰ.探究鋼鐵銹蝕的基本條件
(1)一段時間后,C、D、E中鐵釘生銹,A、B中鐵釘無明顯銹蝕。由A、B、C的現(xiàn)象可知,鐵的銹蝕是鐵跟等物質作用的過程。
(2)使用自來水重新進行如圖實驗,一段時間后發(fā)現(xiàn)試管B中鐵釘生銹了,其可能的原因是。
Ⅱ.探究食鹽水濃度對鋼鐵腐蝕速率的影響
用如圖裝置進行實驗,每組實驗加入鐵炭總質量為24g,食鹽水體積為7.5mL,恰好能將固體潤濕。測得的數(shù)據(jù)見下表:(提供資料:示數(shù)差3cm是指U型管左側液面上升3cm。)
(3)分析食鹽水濃度對鋼鐵腐蝕速率的影響應對比實驗序號 鐵炭質量比 食鹽水濃度/% 示數(shù)差3cm所用時間/s 10分鐘時溫度升高值/℃ 實驗① 2:1 26 90 7.8 實驗② 4:1 26 170 4.2 實驗③ 6:1 26 190 3.3 實驗④ 2:1 13 140 6 實驗⑤ 2:1 6.5 140 6 (填實驗序號)。有同學提出應該再加一組實驗,研究鐵炭質量比為2:1、食鹽水濃度為3.3%時的實驗數(shù)據(jù),你覺得是否有必要,并說明理由。
(4)查閱資料得知,食鹽水中的氯離子能破壞鋼筋表面的鈍化膜,并促使鐵發(fā)生一系列反應得到氫氧化鐵,它在空氣中風化失水后變成氧化鐵。鋼筋銹蝕過程中生成氧化鐵的反應方程式是。
Ⅲ.探究水樣的pH及溶解氧濃度對鋼鐵腐蝕速率的影響
步驟1:按如圖連接好裝置,檢查裝置氣密性。
步驟2:向三頸燒瓶中放入3.5g生鐵粉末,向分液漏斗內(nèi)加入10mL不同濃度的稀鹽酸。
步驟3:將稀鹽酸全部注入三頸燒瓶內(nèi),關閉分液漏斗活塞,一段時間后,至恢復到室溫時,采集的數(shù)據(jù)見下表:
(5)步驟1中檢查裝置氣密性的方法為:先在分液漏斗中加水,再打開活塞,觀察到序號 鹽酸pH P反應前 P反應后 DO反應前 DO反應后 開始降低所需時間/s 實驗① 2.0 90.8 91.8 5.2 4.3 131 實驗② 3.0 90.8 91.5 5.0 3.7 68 實驗③ 4.0 90.8 90.3 4.9 3.4 24 實驗④ 5.0 90.8 90.5 4.9 3.7 98 實驗⑤ 6.0 90.8 90.6 4.4 3.7 175 (填現(xiàn)象),表明裝置的氣密性良好。
(6)實驗①和實驗②反應后壓強變大。進行實驗③時,觀察到溶液中有氣泡冒出,反應后體系內(nèi)壓強卻變小了,變小的原因是。
(7)分析表中數(shù)據(jù),在該實驗條件下,下列說法正確的有(填字母)。
a.當pH=2時,鐵粉與氧氣的銹蝕速率最快
b.稀鹽酸中的溶解氧含量與鹽酸的pH有關
c.鐵粉和鹽酸,氧氣在剛接觸時不是同時發(fā)生反應發(fā)布:2024/12/24 10:30:2組卷:228引用:4難度:0.5 -
3.化學小組對鋼鐵的銹蝕進行實驗研究。
Ⅰ.探究鋼鐵銹蝕的基本條件
(1)一段時間后,C、D、E中鐵釘生銹,A、B中鐵釘無明顯銹蝕。由A、B、C的現(xiàn)象可知,鐵的銹蝕是鐵跟(填化學式)等物質作用的過程。D中鐵釘比C中鐵釘銹蝕程度嚴重,說明。
(2)使用自來水重新進行如圖實驗,一段時間后發(fā)現(xiàn)試管B中鐵釘生銹了,其可能的原因是。
Ⅱ.探究食鹽水對鋼鐵腐蝕速率的影響
用如圖裝置進行實驗,錐形瓶中放生鐵粉末,滴管中預先加入2mL不同濃度的食鹽水,并用氧氣傳感器測定錐形瓶內(nèi)的氧氣濃度,數(shù)據(jù)如下表所示:
(3)該實驗探究的是實驗組 生鐵粉末質量 食鹽水濃度 3min時瓶內(nèi)氧氣濃度 實驗① 3.5g 4% 18.96% 實驗② 3.5g 8% 18.56% 實驗③ 3.5g 16% 18.28% 實驗④ 3.5g 24% 17.99% 對鋼鐵腐蝕速率的影響,其實驗結論是。
(4)查閱資料得知,食鹽水中的氯離子能破壞鋼筋表面的鈍化膜(其原理如圖所示),并促使鐵發(fā)生一系列反應得到Fe(OH)3,F(xiàn)e(OH)3在空氣中風化失水后變成氧化鐵。
①氯離子破壞鋼筋表面的鈍化膜的過程中,從陽極向陰極轉移的微粒是。
②鋼筋銹蝕過程中得到氧化鐵的反應方程式為。
Ⅲ.探究水樣的pH及溶解氧濃度對鋼鐵腐蝕速率的影響
步驟1:按如圖連接好裝置,檢查裝置氣密性。
步驟2:向三頸燒瓶中放入3.5g生鐵粉末,向分液漏斗內(nèi)加入10mL不同濃度的稀鹽酸。
步驟3:將鹽酸全部注入三頸燒瓶內(nèi),關閉分液漏斗活塞,同時采集數(shù)據(jù)見下表:
(5)步驟1中檢查裝置氣密性的方法為序號 鹽酸pH 壓強p/kPa 溶解氧/mg?L-1 p反應前 p反應后 DO反應前 DO反應后 開始降低所需時間/s 實驗① 2.0 90.8 91.8 5.2 4.3 131 實驗② 3.0 90.8 91.5 5.0 3.7 68 實驗③ 4.0 90.8 90.3 4.9 3.4 24 實驗④ 5.0 90.8 90.5 4.9 3.7 98 實驗⑤ 6.0 90.8 90.6 4.4 3.7 175 。
(6)實驗1和實驗2反應后壓強變大的主要原因是(用化學方程式表示)。
(7)進行實驗3時,觀察到溶液中有氣泡冒出,反應后體系內(nèi)壓強卻變小了。其原因是。
(8)分析表中數(shù)據(jù),在該實驗條件下,下列說法正確的有。
A.當pH=2時,鐵粉與氧氣的銹蝕速率最快
B.稀鹽酸中的溶解氧含量與鹽酸的pH有關
C.鐵粉和鹽酸,氧氣的反應可以同時發(fā)生發(fā)布:2024/12/25 12:0:1組卷:264引用:3難度:0.7


