化學小組對鋼鐵的銹蝕進行實驗研究。
Ⅰ.探究鋼鐵銹蝕的基本條件
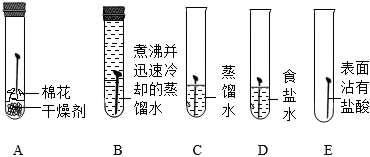
(1)一段時間后,C、D、E中鐵釘生銹,A、B中鐵釘無明顯銹蝕。由A、B、C的現象可知,鐵的銹蝕是鐵跟 O2和H2OO2和H2O(填化學式)等物質作用的過程。D中鐵釘比C中鐵釘銹蝕程度嚴重,說明 食鹽水可以加速鐵的銹蝕食鹽水可以加速鐵的銹蝕。
(2)使用自來水重新進行如圖實驗,一段時間后發現試管B中鐵釘生銹了,其可能的原因是 自來水中含有溶解的氧氣自來水中含有溶解的氧氣。
Ⅱ.探究食鹽水對鋼鐵腐蝕速率的影響
用如圖裝置進行實驗,錐形瓶中放生鐵粉末,滴管中預先加入2mL不同濃度的食鹽水,并用氧氣傳感器測定錐形瓶內的氧氣濃度,數據如下表所示:
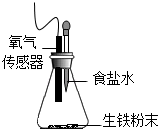
| 實驗組 | 生鐵粉末質量 | 食鹽水濃度 | 3min時瓶內氧氣濃度 |
| 實驗① | 3.5g | 4% | 18.96% |
| 實驗② | 3.5g | 8% | 18.56% |
| 實驗③ | 3.5g | 16% | 18.28% |
| 實驗④ | 3.5g | 24% | 17.99% |
食鹽水濃度
食鹽水濃度
對鋼鐵腐蝕速率的影響,其實驗結論是 食鹽水濃度越大,鐵的銹蝕速率越快
食鹽水濃度越大,鐵的銹蝕速率越快
。(4)查閱資料得知,食鹽水中的氯離子能破壞鋼筋表面的鈍化膜(其原理如圖所示),并促使鐵發生一系列反應得到Fe(OH)3,Fe(OH)3在空氣中風化失水后變成氧化鐵。
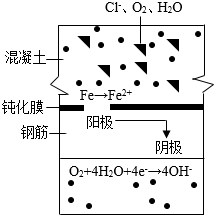
①氯離子破壞鋼筋表面的鈍化膜的過程中,從陽極向陰極轉移的微粒是
電子
電子
。②鋼筋銹蝕過程中得到氧化鐵的反應方程式為
2Fe(OH)3=Fe2O3+3H2O
2Fe(OH)3=Fe2O3+3H2O
。Ⅲ.探究水樣的pH及溶解氧濃度對鋼鐵腐蝕速率的影響
步驟1:按如圖連接好裝置,檢查裝置氣密性。
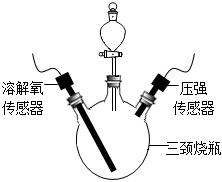
步驟2:向三頸燒瓶中放入3.5g生鐵粉末,向分液漏斗內加入10mL不同濃度的稀鹽酸。
步驟3:將鹽酸全部注入三頸燒瓶內,關閉分液漏斗活塞,同時采集數據見下表:
| 序號 | 鹽酸pH | 壓強p/kPa | 溶解氧/mg?L-1 | |||
| p反應前 | p反應后 | DO反應前 | DO反應后 | 開始降低所需時間/s | ||
| 實驗① | 2.0 | 90.8 | 91.8 | 5.2 | 4.3 | 131 |
| 實驗② | 3.0 | 90.8 | 91.5 | 5.0 | 3.7 | 68 |
| 實驗③ | 4.0 | 90.8 | 90.3 | 4.9 | 3.4 | 24 |
| 實驗④ | 5.0 | 90.8 | 90.5 | 4.9 | 3.7 | 98 |
| 實驗⑤ | 6.0 | 90.8 | 90.6 | 4.4 | 3.7 | 175 |
先在分液漏斗內加水,再打開活塞,觀察若水不往下滴,表明裝置氣密性良好
先在分液漏斗內加水,再打開活塞,觀察若水不往下滴,表明裝置氣密性良好
。(6)實驗1和實驗2反應后壓強變大的主要原因是
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
(用化學方程式表示)。(7)進行實驗3時,觀察到溶液中有氣泡冒出,反應后體系內壓強卻變小了。其原因是
進行實驗3時,觀察到溶液中有氣泡冒出,是因為鹽酸和鐵反應生成了氫氣,但是鐵生銹消耗氧氣,且消耗的氧氣比生成的氫氣多,故反應后體系內壓強變小
進行實驗3時,觀察到溶液中有氣泡冒出,是因為鹽酸和鐵反應生成了氫氣,但是鐵生銹消耗氧氣,且消耗的氧氣比生成的氫氣多,故反應后體系內壓強變小
。(8)分析表中數據,在該實驗條件下,下列說法正確的有
B
B
。A.當pH=2時,鐵粉與氧氣的銹蝕速率最快
B.稀鹽酸中的溶解氧含量與鹽酸的pH有關
C.鐵粉和鹽酸,氧氣的反應可以同時發生
【考點】探究金屬銹蝕的條件.
【答案】O2和H2O;食鹽水可以加速鐵的銹蝕;自來水中含有溶解的氧氣;食鹽水濃度;食鹽水濃度越大,鐵的銹蝕速率越快;電子;2Fe(OH)3=Fe2O3+3H2O;先在分液漏斗內加水,再打開活塞,觀察若水不往下滴,表明裝置氣密性良好;Fe+2HCl=FeCl2+H2↑;進行實驗3時,觀察到溶液中有氣泡冒出,是因為鹽酸和鐵反應生成了氫氣,但是鐵生銹消耗氧氣,且消耗的氧氣比生成的氫氣多,故反應后體系內壓強變小;B
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/12/25 12:0:1組卷:264引用:3難度:0.7
相似題
-
 1.在進行“二氧化碳制取和性質實驗”時,小明發現放置小蠟燭的銅架上出現了綠色物質,且綠色物質只出現在下部(伸到燒杯下面的部分),上部和在燒杯外的部分沒有出現,小明思考,銅也會生銹嗎?為什么只出現在下部呢?銅生銹的條件是什么?
1.在進行“二氧化碳制取和性質實驗”時,小明發現放置小蠟燭的銅架上出現了綠色物質,且綠色物質只出現在下部(伸到燒杯下面的部分),上部和在燒杯外的部分沒有出現,小明思考,銅也會生銹嗎?為什么只出現在下部呢?銅生銹的條件是什么?
【查閱資料】銅在一定條件下會銹蝕生成一種綠色的物質(銅綠),其主要成分是堿式碳酸銅,化學式時候Cu2(OH)2CO3,受熱易分解.
【猜想與假設】依據銅綠的化學式,小明猜想銅生銹的條件可能是,銅與氧氣、共同作用,做出此猜想的依據是.
【設計實驗】將四塊銅片分別按如圖放置半個月,觀察現象如下,A中銅片生銹且水面附近銹蝕最嚴重,B、C、D中銅片不生銹,D裝置中氫氧化鈉溶液的作用是,寫出該反應的化學方程式.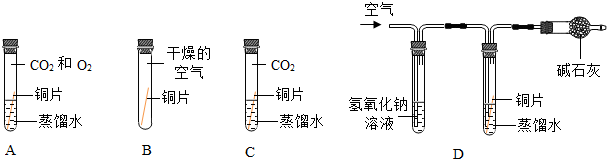
【得出結論】根據A和D中的實驗現象可知銅生銹需要.
【反思與應用】利用所得結論填空,依據本實驗結合“二氧化碳澆滅蠟燭”的實驗操作推測銅架下部容易生銹的原因是.
【實驗拓展】有資料顯示,氧化銅也能加快過氧化氫溶液的分解速率.
(1)給你一支已經產生銅綠的銅架,5%過氧化氫溶液,請你設計實驗證明(儀器自選).
(2)請你試著寫出銅生成銅綠的化學方程式.發布:2024/11/10 8:0:1組卷:54引用:1難度:0.3 -
2.化學小組對鋼鐵的銹蝕進行實驗研究。
Ⅰ.探究鋼鐵銹蝕的基本條件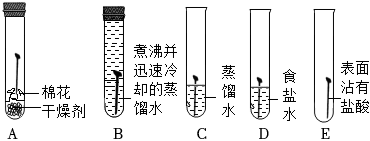
(1)一段時間后,C、D、E中鐵釘生銹,A、B中鐵釘無明顯銹蝕。由A、B、C的現象可知,鐵的銹蝕是鐵跟等物質作用的過程。
(2)使用自來水重新進行如圖實驗,一段時間后發現試管B中鐵釘生銹了,其可能的原因是。
Ⅱ.探究食鹽水濃度對鋼鐵腐蝕速率的影響
用如圖裝置進行實驗,每組實驗加入鐵炭總質量為24g,食鹽水體積為7.5mL,恰好能將固體潤濕。測得的數據見下表:(提供資料:示數差3cm是指U型管左側液面上升3cm。)
(3)分析食鹽水濃度對鋼鐵腐蝕速率的影響應對比實驗序號 鐵炭質量比 食鹽水濃度/% 示數差3cm所用時間/s 10分鐘時溫度升高值/℃ 實驗① 2:1 26 90 7.8 實驗② 4:1 26 170 4.2 實驗③ 6:1 26 190 3.3 實驗④ 2:1 13 140 6 實驗⑤ 2:1 6.5 140 6 (填實驗序號)。有同學提出應該再加一組實驗,研究鐵炭質量比為2:1、食鹽水濃度為3.3%時的實驗數據,你覺得是否有必要,并說明理由。
(4)查閱資料得知,食鹽水中的氯離子能破壞鋼筋表面的鈍化膜,并促使鐵發生一系列反應得到氫氧化鐵,它在空氣中風化失水后變成氧化鐵。鋼筋銹蝕過程中生成氧化鐵的反應方程式是。
Ⅲ.探究水樣的pH及溶解氧濃度對鋼鐵腐蝕速率的影響
步驟1:按如圖連接好裝置,檢查裝置氣密性。
步驟2:向三頸燒瓶中放入3.5g生鐵粉末,向分液漏斗內加入10mL不同濃度的稀鹽酸。
步驟3:將稀鹽酸全部注入三頸燒瓶內,關閉分液漏斗活塞,一段時間后,至恢復到室溫時,采集的數據見下表: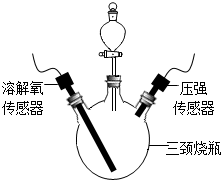
(5)步驟1中檢查裝置氣密性的方法為:先在分液漏斗中加水,再打開活塞,觀察到序號 鹽酸pH P反應前 P反應后 DO反應前 DO反應后 開始降低所需時間/s 實驗① 2.0 90.8 91.8 5.2 4.3 131 實驗② 3.0 90.8 91.5 5.0 3.7 68 實驗③ 4.0 90.8 90.3 4.9 3.4 24 實驗④ 5.0 90.8 90.5 4.9 3.7 98 實驗⑤ 6.0 90.8 90.6 4.4 3.7 175 (填現象),表明裝置的氣密性良好。
(6)實驗①和實驗②反應后壓強變大。進行實驗③時,觀察到溶液中有氣泡冒出,反應后體系內壓強卻變小了,變小的原因是。
(7)分析表中數據,在該實驗條件下,下列說法正確的有(填字母)。
a.當pH=2時,鐵粉與氧氣的銹蝕速率最快
b.稀鹽酸中的溶解氧含量與鹽酸的pH有關
c.鐵粉和鹽酸,氧氣在剛接觸時不是同時發生反應發布:2024/12/24 10:30:2組卷:229引用:4難度:0.5 -
 3.銅器長時間暴露在空氣中會生成銅綠[Cu2(OH)2CO3],銅綠不穩定,受熱會生成三種氧化物。
3.銅器長時間暴露在空氣中會生成銅綠[Cu2(OH)2CO3],銅綠不穩定,受熱會生成三種氧化物。
(1)根據銅綠的化學式,你認為銅綠的形成是銅與、和氧氣共同作用的結果,你判斷的依據是。
(2)為探究銅綠的組成,小芳同學從銅器上取下適量的銅綠放入下圖所示的裝置中,加熱后,可能出現的現象是。
(3)請你設計一個實驗證明銅綠的組成中含有銅元素(寫出操作步驟、現象和結論)操作步驟 現象 結論 發布:2024/11/10 8:0:1組卷:28引用:1難度:0.4


