某小組進行如下實驗:向0.1mol?L-1FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到紅色溶液。
已知:溶液中+4價含硫微粒物質的量分數隨pH變化的曲線如圖所示。
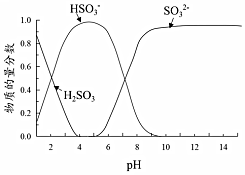
I.推測Fe3+與溶液中的某種+4價含硫微粒形成了紅色的配離子。設計如下實驗(均在常溫下進行):
| 實驗 | 溶液1(1mL) | 溶液2(10mL) | 現象 |
| A | 0.1mol?L-1FeCl3溶液 | SO2的飽和溶液 | 溶液1與溶液2混合后,實驗A、B、C所得溶液紅色依次加深 |
| B | 0.1mol?L-1FeCl3溶液 | SO2的飽和溶液,用NaOH固體調pH=5.0 | |
| C | 0.1mol?L-1FeCl3溶液 |
SO2的飽和溶液,用NaOH固體調pH=10 SO2的飽和溶液,用NaOH固體調pH=10
|
(2)配離子的配體為SO32-的實驗證據是
隨著c(SO32-)增大,溶液紅色加深
隨著c(SO32-)增大,溶液紅色加深
。II.探究pH對FeCl3和Na2SO3反應的影響。設計如下實驗:
| 序號 | 實驗a | 實驗b |
| 方案 | 5mL酸化的0.1mol?L-1FeCl3與2mL0.1mol?L-1Na2SO3混合得紅色溶液,測得pH=1.7 | 5mL酸化的0.1mol?L-1FeCl3與2mL0.1mol?L-1Na2SO3混合得紅色溶液,加幾滴濃鹽酸,調pH=1.3 |
| 現象 | 放置10分鐘后,溶液紅色均褪去,實驗b中溶液褪色更快。經檢驗,褪色后的溶液中均存在Fe2+。 | |
i.甲認為pH降低,有利于Fe3+氧化SO32-,導致實驗b中溶液褪色更快。
①從電極反應的角度,進行理論分析:還原反應為:Fe3++e-═Fe2+氧化反應為:
SO32-+H2O-2e-=SO42-+2H+
SO32-+H2O-2e-=SO42-+2H+
。②已知上述實驗條件下pH對Fe3+的氧化性幾乎沒有影響。從平衡移動的角度判斷pH對SO32-還原性的影響是
減弱
減弱
(填“增強”或“減弱”)。③通過理論分析,甲認為其猜測
不成立
不成立
(填“成立”或“不成立”),并進一步實驗,獲得了證據。實驗方案為:反應相同時間,分別取實驗a和b中的溶液,檢測 Fe2+
Fe2+
濃度(填離子符號),比較其大小關系。ii.乙猜測pH降低,有利于
O2
O2
氧化SO32-,導致實驗b中溶液褪色更快。④將乙的假設補充完整
pH降低不利于O2氧化SO32-
pH降低不利于O2氧化SO32-
(填化學式)。⑤乙設計實驗進行驗證:
取10mL0.1mol?L-1Na2SO3溶液加硫酸調pH=1.7,用KMnO4溶液滴定,消耗體積為V1。另取一份相同的溶液放置10分鐘后,再用KMnO4溶液滴定,消耗體積為V2。前后差值(V1-V2)為ΔVa。用同樣的方法對10mL0.1mol?L-1Na2SO3(含H2SO4)pH=1.3進行滴定,消耗KMnO4溶液前后體積差值為ΔVb。經對比可知,ΔVa>ΔVb,由此得出的實驗結論是
乙猜測不成立
乙猜測不成立
。(4)綜合上述分析,pH降低,有利于
SO32-與H+
SO32-與H+
反應的發生,導致實驗b中溶液褪色更快。【考點】鐵及其化合物的性質實驗.
【答案】SO2的飽和溶液,用NaOH固體調pH=10;隨著c(SO32-)增大,溶液紅色加深;SO32-+H2O-2e-=SO42-+2H+;減弱;不成立;Fe2+;O2;pH降低不利于O2氧化SO32-;乙猜測不成立;SO32-與H+
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:107引用:2難度:0.6
相似題
-
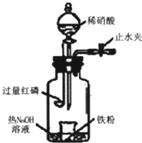 1.某同學用圖示裝置進行鐵和稀硝酸反應的實驗并進行相關的實驗探究.
1.某同學用圖示裝置進行鐵和稀硝酸反應的實驗并進行相關的實驗探究.
a.向廣口瓶內注入足量熱NaOH溶液,將盛有一定質量的純鐵粉的小燒杯放入瓶中.
b.關閉止水夾,點燃紅磷,伸入瓶中,塞好膠塞.
c.待紅磷充分燃燒,一段時間后打開分液漏斗旋塞,向燒杯中緩慢滴入一定量的4mol?L-1的稀硝酸,鐵粉完全溶解.
氣體產物成分探究
(1)實驗前如何檢查該裝置的氣密性?.
(2)燃燒紅磷的目的是.
(3)為證明氣體產物為NO,步驟c后還缺少的一步主要操作是.
產物中鐵元素價態探究:
(4)提出合理假設:
假設1:產物中只有+2價鐵;假設2:,
假設3:產物中既有+2價鐵,又有+3價鐵.
(5)設計實驗方案,驗證假設1成立(寫出實驗操作步驟現象和結論):.
問題討論:
(6)廣口瓶中熱NaOH溶液的主要作用是.若假設3成立,且所得溶液中n(Fe2+):n(Fe3+)=3:1時,則對應的離子反應方程式為.發布:2024/11/4 8:0:2組卷:64引用:5難度:0.3 -
2.鐵粉具有平肝鎮心,消癡解毒之功效,主治驚痛、癲狂、腳氣沖心、貧血等。某興趣小組探究利用反應:H2+FeCO3
Fe+CO2↑+H2O↑制取鐵粉并檢驗氣體產物實驗裝置如圖。下列說法不正確的是( )△
A.通過調節分液漏斗的活塞可以控制①中氣泡產生快慢 B.裝置①中的試劑是濃硫酸,目的是干燥氫氣 C.裝置②中的試劑是無水硫酸銅,目的是檢驗水蒸氣 D.為防止④中揮發的氣體進入②中干擾檢驗,③中應盛放堿石灰 發布:2024/11/17 13:0:1組卷:359引用:9難度:0.5 -
3.兩組同學對鐵及其化合物的性質進行探究.
(1)一組同學用圖1所示裝置對鐵與濃硫酸的反應進行實驗.已知:
2Fe+6H2SO4(濃)Fe2(SO4)3+3SO2↑+6H2O.請你參與探究并回答相關問題.△
①檢查裝置氣密性后,將過量的鐵屑和一定量的濃硫酸放入燒瓶,塞緊橡皮塞,開始計時.t1時開始加熱,在鐵屑表面逐漸產生氣泡,當有大量氣泡產生時,控制反應溫度基本不變.甲同學將收集到的氣體體積與時間的關系粗略地表示為圖2.
在0~t1時間段,鐵屑表面沒有氣泡生成,說明鐵在濃硫酸中發生了;
t1~t2時間段,反應生成的氣體是.
②t2時,取少量反應液,先滴加少量新制飽和氯水,然后滴加KSCN溶液,呈現血紅色.若再滴加過量新制氯水,卻發現紅色褪去.同學們對紅色褪去的原因提出各自的假設.乙同學的假設是:溶液中的+3價鐵被氧化為更高的價態.你的另一種假設是;為了驗證你的假設,請設計一種簡便的實驗方案.
(2)另一組同學對鐵和稀硝酸的反應進行探究.他們用a mol Fe和含有b mol HNO3的稀硝酸進行實驗,若HNO3只被還原成NO,且反應結束后溶液中含有Fe3+和Fe2+,則的取值范圍是ab;若反應結束后的溶液中n(Fe3+):n(Fe2+)=2:1,則的值為ab.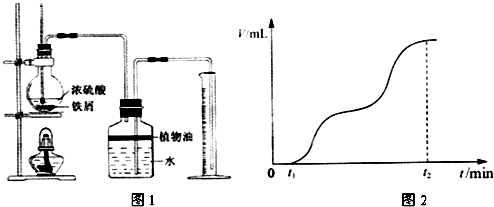 發布:2024/11/4 8:0:2組卷:57引用:5難度:0.1
發布:2024/11/4 8:0:2組卷:57引用:5難度:0.1
相關試卷


