2022年北京市順義一中高考化學三模試卷
發布:2024/4/20 14:35:0
一、選擇題第一部分(42分)在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.近年來我國取得讓世界矚目的科技成果,化學功不可沒。下列說法不正確的是( )
A.“天和核心艙”電推進系統中的腔體采用氮化硼陶瓷屬于有機物 B.“嫦娥五號”運載火箭用液氧液氫推進劑,產物對環境無污染 C.“奮斗者”號潛水器外殼材料為鈦合金,鈦元素屬于過渡元素 D.“神舟載人飛船”太陽敏感器光學窗口采用石英玻璃,主要成分二氧化硅屬于共價晶體 組卷:21引用:2難度:0.7 -
2.下列化學用語或圖示表達正確的是( )
A.Cl2的電子式Cl:Cl B.CO2的VSEPR模型 
C.Mg的原子結構示意圖 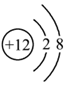
D.苯的分子結構模型  組卷:77引用:3難度:0.6
組卷:77引用:3難度:0.6 -
3.下列說法正確的是( )
A.第一電離能:C>Be>B B.金屬性:Li>Na>K C.熱穩定性:H2S>HCl>HF D.電負性:Cl<S<P 組卷:68引用:2難度:0.6 -
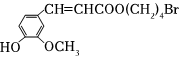 4.化合物M是一種治療腦卒中藥物中間體,其結構簡式如圖。下列關于該有機物的說法不正確的是( )
4.化合物M是一種治療腦卒中藥物中間體,其結構簡式如圖。下列關于該有機物的說法不正確的是( )A.存在順反異構 B.1mol該有機物最多消耗2molNaOH C.能與Br2發生取代反應和加成反應 D.分子中有3種含氧官能團 組卷:46引用:4難度:0.5 -
5.某同學進行如下實驗:向酸化的過氧化氫溶液中加入碘化鉀、淀粉和維生素C溶液,一段時間后溶液變藍。查閱資料可知體系中存在兩個主要反應:
反應i:H2O2+2I-+2H+═I2+2H2O
反應ii:C6H8O6(維生素C)+I2═C6H6O6+2I-+2H+
下列說法不正確的是( )A.反應ii中維生素C發生氧化反應 B.反應速率:反應i<反應ii C.溶液pH最終會變大 D.若溶液變藍時n(I2)=amol,則消耗n(H2O2)=amol 組卷:138引用:4難度:0.4 -
6.下列實驗方案不能達到實驗目的的是( )
選項 實驗方案 實驗目的 A 向兩份KMnO4酸性溶液中分別通入足量乙烯或加入足量苯 驗證苯分子中不存在碳碳雙鍵 B 向FeCl3和KSCN的混合溶液中加入固體KCl 驗證生成物濃度改變對化學平衡的影響 C 向H2S溶液中通入SO2氣體混合 驗證SO2具有氧化性 D 用pH計測定等物質的量濃度的CH3COONa溶液和NaClO溶液的pH 比較CH3COOH和HClO的酸性強弱 A.A B.B C.C D.D 組卷:46引用:4難度:0.5
二、非選擇題第二部分(58分)
-
18.鈦白粉(納米級)廣泛應用于功能陶瓷、催化劑、化妝品和光敏材料等白色無機顏料。是白色顏料中著色力最強的一種,具有優良的遮蓋力和著色牢度,適用于不透明的白色制品。制備原料鈦鐵礦(FeTiO3)中往往含有Fe2O3、MgO、CaO、Al2O3、SiO2等雜質。一種硫酸法制取白色顏料鈦白粉(TiO2)生產工藝如圖1:
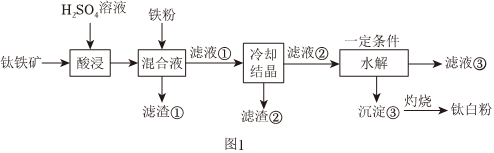
已知:①酸浸后,鈦主要以TiOSO4形式存在;
②強電解質TiOSO4在溶液中僅能電離出和一種陽離子。SO2-4
③H2TiO3不溶于水和稀酸。
(1)要提高酸浸速率,可采取的措施是(寫出一條即可)。
(2)濾渣①中除鐵粉外,還可能含有的成分是。
(3)酸浸過程中,FeTiO3發生反應的離子方程式。
(4)加入鐵粉的目的是還原體系中的Fe3+。為探究最佳反應條件,某實驗室做了如下嘗試。
①在其它條件不變的情況下,體系中Fe(Ⅲ)[指Fe3+和Fe(OH)3等含正三價鐵元素的微粒]含量隨pH變化如圖2,試分析,在pH介于4~6之間時,Fe(Ⅲ)主要以(填微粒化學式)形式存在。
②保持其它條件不變,體系中Fe(Ⅲ)含量隨溫度變化如圖3,請從化學平衡原理角度分析,55℃后,Fe(Ⅲ)含量增大的原因是。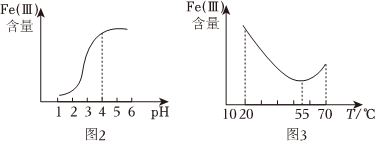
(5)“水解”過程中得到的沉淀③的化學式為。組卷:29引用:4難度:0.6 -
19.某小組進行如下實驗:向0.1mol?L-1FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到紅色溶液。
已知:溶液中+4價含硫微粒物質的量分數隨pH變化的曲線如圖所示。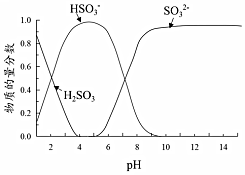
I.推測Fe3+與溶液中的某種+4價含硫微粒形成了紅色的配離子。設計如下實驗(均在常溫下進行):
(1)將上述實驗補充完整。實驗 溶液1(1mL) 溶液2(10mL) 現象 A 0.1mol?L-1FeCl3溶液 SO2的飽和溶液 溶液1與溶液2混合后,實驗A、B、C所得溶液紅色依次加深 B 0.1mol?L-1FeCl3溶液 SO2的飽和溶液,用NaOH固體調pH=5.0 C 0.1mol?L-1FeCl3溶液
(2)配離子的配體為SO32-的實驗證據是。
II.探究pH對FeCl3和Na2SO3反應的影響。設計如下實驗:
(3)探究實驗b中溶液褪色更快的原因:序號 實驗a 實驗b 方案 5mL酸化的0.1mol?L-1FeCl3與2mL0.1mol?L-1Na2SO3混合得紅色溶液,測得pH=1.7 5mL酸化的0.1mol?L-1FeCl3與2mL0.1mol?L-1Na2SO3混合得紅色溶液,加幾滴濃鹽酸,調pH=1.3 現象 放置10分鐘后,溶液紅色均褪去,實驗b中溶液褪色更快。經檢驗,褪色后的溶液中均存在Fe2+。
i.甲認為pH降低,有利于Fe3+氧化SO32-,導致實驗b中溶液褪色更快。
①從電極反應的角度,進行理論分析:還原反應為:Fe3++e-═Fe2+氧化反應為:。
②已知上述實驗條件下pH對Fe3+的氧化性幾乎沒有影響。從平衡移動的角度判斷pH對SO32-還原性的影響是(填“增強”或“減弱”)。
③通過理論分析,甲認為其猜測(填“成立”或“不成立”),并進一步實驗,獲得了證據。實驗方案為:反應相同時間,分別取實驗a和b中的溶液,檢測濃度(填離子符號),比較其大小關系。
ii.乙猜測pH降低,有利于氧化SO32-,導致實驗b中溶液褪色更快。
④將乙的假設補充完整(填化學式)。
⑤乙設計實驗進行驗證:
取10mL0.1mol?L-1Na2SO3溶液加硫酸調pH=1.7,用KMnO4溶液滴定,消耗體積為V1。另取一份相同的溶液放置10分鐘后,再用KMnO4溶液滴定,消耗體積為V2。前后差值(V1-V2)為ΔVa。用同樣的方法對10mL0.1mol?L-1Na2SO3(含H2SO4)pH=1.3進行滴定,消耗KMnO4溶液前后體積差值為ΔVb。經對比可知,ΔVa>ΔVb,由此得出的實驗結論是。
(4)綜合上述分析,pH降低,有利于反應的發生,導致實驗b中溶液褪色更快。組卷:107引用:2難度:0.6


