已知298K時,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0×10-18,其沉淀溶解平衡曲線如圖所示(圖中R表示Ni或Fe),下列說法正確的是(已知:6≈2.4,10≈3.2)( )
6
10
【考點】沉淀溶解平衡的應用.
【答案】D
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/5/27 14:0:0組卷:71引用:2難度:0.7
相似題
-
1.下列有關AgCl的沉淀溶解平衡的說法正確的是( )
A.AgCl飽和溶液中沉淀生成和溶解的速率為0 B.AgCl難溶于水,則溶液中沒有Ag+和Cl- C.向含有AgCl的飽和溶液中加入濃鹽酸,一定會有沉淀生成 D.向含有AgCl的懸濁液中加入NaBr固體,AgCl沉淀含量無變化 發布:2024/8/17 4:0:1組卷:10引用:2難度:0.7 -
 2.(1)已知:常溫下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
2.(1)已知:常溫下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常溫下,某酸性MgCl2溶液中含有少量的FeCl3,為了得到純凈的MgCl2?2H2O晶體,應加入(填化學式),調節溶液的pH=4,使溶液中的Fe3+轉化為Fe(OH)3沉淀,此時溶液中的c(Fe3+)=mol?L-1。
②常溫下,若將0.01 mol?L-1 MgCl2溶液與mol?L-1 NaOH溶液等體積混合時有沉淀生成。
(2)已知肼(N2H4)是一種清潔高效的火箭燃料,0.25 mol N2H4(g)完全燃燒生成氮氣和氣態水時,放出133.5 kJ熱量。該反應的熱化學方程式:。
(3)燃料電池是一種高效低污染的新型電池,肼(N2H4)-空氣燃料電池是一種堿性燃料電池,其工作原理如圖所示:
①寫出電池中通入N2H4的一極的電極的反應:。
②電池工作時,正極附近的pH(填“增大”或者“不變”或者“減小”)。發布:2024/6/27 10:35:59組卷:18引用:2難度:0.9 -
3.亞磷酸(H3PO3)與足量的NaOH溶液反應生成Na2HPO3。
(1)亞磷酸中P的化合價為價,是元酸。
(2)在H3PO3溶液中存在電離平衡:H3PO3?H++H2PO3-。
①某溫度下,0.10mol?L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×10-2mol?L-1。則該溫度下,上述電離平衡的平衡常數K=(只考慮H3PO3的第一步電離,結果保留兩位有效數字)。
②根據H3PO3的性質可推測Na2HPO3稀溶液的pH7(填“>”、“=”或“<”)。
(3)亞磷酸具有強還原性,可將Cu2+還原為金屬單質,H3PO3與CuSO4溶液反應的化學方程式為。
(4)電解Na2HPO3溶液也可得到亞磷酸,裝置示意圖如圖。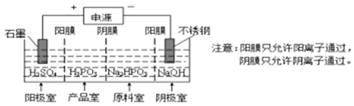
①陰極的電極反應式為。
②產品室中反應的離子方程式為。
(5)在熱水中,PCl5能完全水解,生成磷酸(H3PO4),若將0.01mol PCl5投入1L熱水中,再逐滴加入AgNO3溶液,先產生的沉淀是(填化學式)。[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]發布:2024/12/12 8:0:1組卷:9引用:1難度:0.5


