在高效復(fù)習(xí)課堂中,同學(xué)們利用“硫酸、硝酸鋇、氫氧化鈉、碳酸鉀”四種物質(zhì)的溶液對(duì)“復(fù)分解反應(yīng)發(fā)生的條件”進(jìn)行再探究。
【知識(shí)回放】
判斷上述四種溶液兩兩之間能否發(fā)生反應(yīng),寫(xiě)出其中符合下列條件的兩個(gè)化學(xué)方程式:
①一個(gè)中和反應(yīng):H2SO4+2NaOH=Na2SO4+2H2OH2SO4+2NaOH=Na2SO4+2H2O。
②一個(gè)有沉淀生成的反應(yīng):H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3。
【挖掘?qū)嵸|(zhì)】
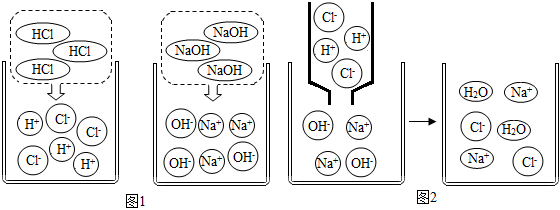
(1)圖1是HCl和NaOH在水中解離出離子的示意圖,小麗發(fā)現(xiàn)HCl在水中會(huì)解離出H+和Cl-,NaOH在水中會(huì)解離出Na+和OH-,以此類推硝酸鋇在水中會(huì)解離出的離子是 Ba2+和NO3-Ba2+和NO3-(填離子符號(hào))。
(2)圖2是稀鹽酸和氫氧化鈉溶液發(fā)生化學(xué)反應(yīng)的微觀過(guò)程示意圖,該化學(xué)反應(yīng)的實(shí)質(zhì)可以表示為H++OH-═H2O。用同樣的方式表示上述四種溶液兩兩之間發(fā)生反應(yīng)時(shí),有氣體生成的反應(yīng)的實(shí)質(zhì):2H++CO32-═H2O+CO2↑2H++CO32-═H2O+CO2↑。
【實(shí)踐運(yùn)用】
利用上述四種物質(zhì)的溶液完成實(shí)驗(yàn)后,將所得物質(zhì)混合并過(guò)濾,得到一種無(wú)色溶液。經(jīng)測(cè)定,該溶液顯酸性。則在該溶液中一定含有的離子是 H+、Na+、K+、NO3-H+、Na+、K+、NO3-。
為了驗(yàn)證該溶液中可能含有的離子是否存在,同學(xué)們?cè)O(shè)計(jì)如下實(shí)驗(yàn)進(jìn)行驗(yàn)證。
| 溶液中可能含有的離子 | 實(shí)驗(yàn)步驟 | 實(shí)驗(yàn)現(xiàn)象 | 實(shí)驗(yàn)結(jié)論 |
| 可能含有 鋇離子(或硫酸根離子) 鋇離子(或硫酸根離子) |
向?yàn)V液中滴加 硫酸(或氯化鋇溶液) 硫酸(或氯化鋇溶液) |
產(chǎn)生白色沉淀 | 含有該離子 |
對(duì)“復(fù)分解反應(yīng)發(fā)生的條件”的再探究,同學(xué)們發(fā)現(xiàn)在分析多種溶液混合后所得溶液中離子的成分時(shí),應(yīng)考慮的因素是
溶液中的離子能否大量共存或者離子是否參加化學(xué)反應(yīng),參加化學(xué)反應(yīng)的離子是否有剩余
溶液中的離子能否大量共存或者離子是否參加化學(xué)反應(yīng),參加化學(xué)反應(yīng)的離子是否有剩余
。【考點(diǎn)】復(fù)分解反應(yīng)的實(shí)質(zhì)與應(yīng)用.
【答案】H2SO4+2NaOH=Na2SO4+2H2O;H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3;Ba2+和NO3-;2H++CO32-═H2O+CO2↑;H+、Na+、K+、NO3-;鋇離子(或硫酸根離子);硫酸(或氯化鋇溶液);溶液中的離子能否大量共存或者離子是否參加化學(xué)反應(yīng),參加化學(xué)反應(yīng)的離子是否有剩余
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:46引用:1難度:0.5
相似題
-
1.下列各組溶液,相互能發(fā)生反應(yīng)的是( )
A.碳酸鉀和硝酸鋇 B.硝酸鋇和鹽酸 C.氫氧化鈉和碳酸鉀 D.硫酸鈉和碳酸鉀 發(fā)布:2024/12/25 16:0:1組卷:119引用:7難度:0.9 -
2.在宏觀、微觀和符號(hào)之間建立聯(lián)系是化學(xué)學(xué)科的重要思維方式。

(1)如圖1是鎂原子和鍶原子結(jié)構(gòu)示意圖。
①鎂和鍶兩種元素的最本質(zhì)區(qū)別是。
②鍶與地殼中含量最多的元素形成的化合物為(填化學(xué)式)。
③元素的性質(zhì)與其原子結(jié)構(gòu)有密切關(guān)系。原子的最外層電子數(shù)相同時(shí),電子層數(shù)越多,最外層電子離核越遠(yuǎn),原子核對(duì)最外層電子的吸引力越小。由此推測(cè),鍶(Sr)的金屬的活動(dòng)性比鎂(Mg)的金屬活動(dòng)性(填“強(qiáng)”或“弱”)。
(2)氮及其化合物的“化合價(jià)-物質(zhì)類別”關(guān)系圖如圖2。
①甲在空氣中的體積分?jǐn)?shù)為;丙的化學(xué)式為HNO3,該物質(zhì)的名稱是。
②若丁是工業(yè)用鹽NaNO2,能區(qū)別NaNO2溶液與食鹽溶液的一種試劑是。(友情提示:NaNO2有毒,有咸味,外形與食鹽相似,其水溶液呈堿性,AgNO2微溶于水。)
(3)圖3描述了NaOH與NaHSO4兩溶液反應(yīng)的微觀示意圖。
①NaHSO4物質(zhì)類別屬于(填“酸”、“堿”或“鹽”)。
②寫(xiě)出與該反應(yīng)微觀本質(zhì)相同的另一化學(xué)方程式。發(fā)布:2024/12/24 9:0:1組卷:125引用:2難度:0.7 -
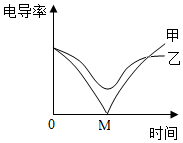 3.電導(dǎo)率傳感器可輔助探究復(fù)分解反應(yīng)的實(shí)質(zhì),相同條件下,離子濃度越大,電導(dǎo)率越大,溶液導(dǎo)電性越強(qiáng).將含有酚酞的Ba(OH)2溶液平均分成兩份置于兩個(gè)燒杯中并插入電導(dǎo)率傳感器,往其中一份滴加稀硫酸,往另一份滴加硫酸鈉溶液,測(cè)得溶液的電導(dǎo)率變化如圖所示.下列說(shuō)法正確的是( )
3.電導(dǎo)率傳感器可輔助探究復(fù)分解反應(yīng)的實(shí)質(zhì),相同條件下,離子濃度越大,電導(dǎo)率越大,溶液導(dǎo)電性越強(qiáng).將含有酚酞的Ba(OH)2溶液平均分成兩份置于兩個(gè)燒杯中并插入電導(dǎo)率傳感器,往其中一份滴加稀硫酸,往另一份滴加硫酸鈉溶液,測(cè)得溶液的電導(dǎo)率變化如圖所示.下列說(shuō)法正確的是( )A.甲曲線對(duì)應(yīng)的是氫氧化鋇與硫酸鈉反應(yīng) B.甲曲線上的M點(diǎn)代表兩種溶液恰好完全反應(yīng) C.乙曲線電導(dǎo)率減小過(guò)程中,溶液由紅色變?yōu)闊o(wú)色 D.乙曲線對(duì)應(yīng)的反應(yīng)中四種離子數(shù)目都減少 發(fā)布:2024/12/25 11:0:2組卷:176引用:4難度:0.5
相關(guān)試卷


