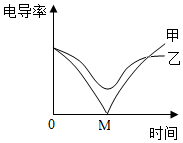
 電導率傳感器可輔助探究復分解反應的實質,相同條件下,離子濃度越大,電導率越大,溶液導電性越強.將含有酚酞的Ba(OH)2溶液平均分成兩份置于兩個燒杯中并插入電導率傳感器,往其中一份滴加稀硫酸,往另一份滴加硫酸鈉溶液,測得溶液的電導率變化如圖所示.下列說法正確的是( )
電導率傳感器可輔助探究復分解反應的實質,相同條件下,離子濃度越大,電導率越大,溶液導電性越強.將含有酚酞的Ba(OH)2溶液平均分成兩份置于兩個燒杯中并插入電導率傳感器,往其中一份滴加稀硫酸,往另一份滴加硫酸鈉溶液,測得溶液的電導率變化如圖所示.下列說法正確的是( )
【考點】復分解反應的實質與應用.
【答案】B
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/12/25 11:0:2組卷:174引用:4難度:0.5
相似題
-
1.下列各組溶液,相互能發生反應的是( )
A.碳酸鉀和硝酸鋇 B.硝酸鋇和鹽酸 C.氫氧化鈉和碳酸鉀 D.硫酸鈉和碳酸鉀 發布:2024/12/25 16:0:1組卷:119引用:7難度:0.9 -
2.在宏觀、微觀和符號之間建立聯系是化學學科的重要思維方式。

(1)如圖1是鎂原子和鍶原子結構示意圖。
①鎂和鍶兩種元素的最本質區別是。
②鍶與地殼中含量最多的元素形成的化合物為(填化學式)。
③元素的性質與其原子結構有密切關系。原子的最外層電子數相同時,電子層數越多,最外層電子離核越遠,原子核對最外層電子的吸引力越小。由此推測,鍶(Sr)的金屬的活動性比鎂(Mg)的金屬活動性(填“強”或“弱”)。
(2)氮及其化合物的“化合價-物質類別”關系圖如圖2。
①甲在空氣中的體積分數為;丙的化學式為HNO3,該物質的名稱是。
②若丁是工業用鹽NaNO2,能區別NaNO2溶液與食鹽溶液的一種試劑是。(友情提示:NaNO2有毒,有咸味,外形與食鹽相似,其水溶液呈堿性,AgNO2微溶于水。)
(3)圖3描述了NaOH與NaHSO4兩溶液反應的微觀示意圖。
①NaHSO4物質類別屬于(填“酸”、“堿”或“鹽”)。
②寫出與該反應微觀本質相同的另一化學方程式。發布:2024/12/24 9:0:1組卷:122引用:2難度:0.7 -
3.復分解反應是中學化學常見的一種反應類型,它有這樣一種規律:一種酸與另一種相對較弱酸的鹽可以自發地反應,生成較弱酸和較強酸的鹽。
(1)已知酸性由強到弱順序為:H2SO4>H2SO3>H2S>H2CO3>HClO
①寫出向NaClO溶液中通入少量CO2的化學方程式。
②將混有CO2氣體的SO2氣體通入飽和NaHSO3溶液,(填“能”或“不能”)除CO2氣體。
(2)復分解反應從形式上看,是一種相互交換成分的反應,在有機反應中,也有相類似形式的反應-“烯烴復分解”反應
如果用重氫(元素符號為D)標記過的烯烴CD3CD=CDCD3和烴CH3CH=CHCH3進行反應,其化學方程式是CD3CD=CDCD3+CH3CH=CHCH3=2
(3)復分解反應的發生還遵循向生成沉淀、氣體、難電離的方向進行。
①甲同學認為CuSO4+H2S=H2SO4+CuS↓不能發生,因為違背了“較強酸制較弱酸”的原則,他的觀點是錯誤的,因為CuS。
②乙同學認為,H2SO3酸性弱于HNO3,SO2通入Ba(NO3)2溶液中不發生化學反應,但經過實驗探究發現,有白色沉淀生成,寫出該反應的化學方程式:
3SO2+3Ba(NO3)2+2=3↓+NO↑+4HNO3發布:2024/10/25 17:0:1組卷:21引用:1難度:0.7


