重金屬離子會對人體造成危害,需回收利用。
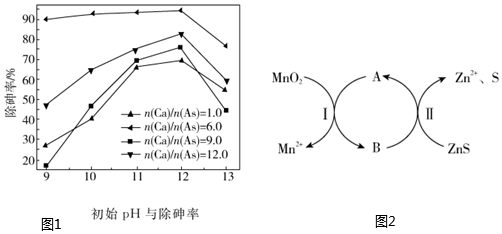
(1)在硫酸廢水中加入亞鐵鹽(FeSO4)和石灰,再通過充分曝氣氧化,將大部分Fe2+氧化為Fe3+大部分的AsO2-轉(zhuǎn)變成AsO43-,生成具有較小溶解度的砷酸鐵渣沉淀。
①AsO2-轉(zhuǎn)變成AsO43-的離子方程式為2AsO2-+O2+2H2O=2AsO43-+4H+2AsO2-+O2+2H2O=2AsO43-+4H+
②當(dāng)pH大于12后,除砷率整體呈現(xiàn)下降的趨勢(如圖1),其原因是pH過大時,F(xiàn)e3+與OH-生成了氫氧化鐵沉淀,與AsO43-結(jié)合生成砷酸鐵的Fe3+減少,從而導(dǎo)致除砷率下降pH過大時,F(xiàn)e3+與OH-生成了氫氧化鐵沉淀,與AsO43-結(jié)合生成砷酸鐵的Fe3+減少,從而導(dǎo)致除砷率下降
③檢驗溶液中有Fe2+的方法是向待檢液中加入KSCN溶液,無現(xiàn)象,然后滴加少量氯水,溶液顯血紅色,則待檢液中含有Fe2+向待檢液中加入KSCN溶液,無現(xiàn)象,然后滴加少量氯水,溶液顯血紅色,則待檢液中含有Fe2+
(2)已知:反應(yīng)的離子方程式為ZnS+MnO2+4H+═Zn2++Mn2++S+2H2O。具體轉(zhuǎn)化如圖2。溶液中加入Fe3+可以促進反應(yīng)的發(fā)生,反應(yīng)過程可描述為酸性條件下,二氧化錳和亞鐵離子反應(yīng)生成了錳離子和三價鐵離子,三價鐵離子再將硫化鋅氧化為單質(zhì)硫和鋅離子,自身被還原為亞鐵離子酸性條件下,二氧化錳和亞鐵離子反應(yīng)生成了錳離子和三價鐵離子,三價鐵離子再將硫化鋅氧化為單質(zhì)硫和鋅離子,自身被還原為亞鐵離子
(3)銅制印刷電路板蝕刻液的選擇及再生回收是研究熱點。用堿性CuCl2溶液(用NH3?H2O-NH4Cl調(diào)節(jié)pH)作蝕刻液,CuCl2+4NH3?H2O═Cu(NH3)4Cl2+4H2O;Cu(NH3)4Cl2+Cu═2Cu(NH3)2Cl。pH約為8.3~9.0的效果最好,其原因是pH太低,NH3?H2O濃度小,Cu2+和生成的Cu+不能形成[Cu(NH3)4]2+和[Cu(NH3)4]+,pH過高,Cu2+和生成的Cu+會轉(zhuǎn)化為氫氧化銅沉淀或氫氧化亞銅沉淀pH太低,NH3?H2O濃度小,Cu2+和生成的Cu+不能形成[Cu(NH3)4]2+和[Cu(NH3)4]+,pH過高,Cu2+和生成的Cu+會轉(zhuǎn)化為氫氧化銅沉淀或氫氧化亞銅沉淀。
【考點】“三廢”處理與環(huán)境保護.
【答案】2AsO2-+O2+2H2O=2AsO43-+4H+;pH過大時,F(xiàn)e3+與OH-生成了氫氧化鐵沉淀,與AsO43-結(jié)合生成砷酸鐵的Fe3+減少,從而導(dǎo)致除砷率下降;向待檢液中加入KSCN溶液,無現(xiàn)象,然后滴加少量氯水,溶液顯血紅色,則待檢液中含有Fe2+;酸性條件下,二氧化錳和亞鐵離子反應(yīng)生成了錳離子和三價鐵離子,三價鐵離子再將硫化鋅氧化為單質(zhì)硫和鋅離子,自身被還原為亞鐵離子;pH太低,NH3?H2O濃度小,Cu2+和生成的Cu+不能形成[Cu(NH3)4]2+和[Cu(NH3)4]+,pH過高,Cu2+和生成的Cu+會轉(zhuǎn)化為氫氧化銅沉淀或氫氧化亞銅沉淀
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:21引用:1難度:0.7
相似題
-
1.下列說法不正確的是( )
A.酸雨與土壤中的金屬氧化物反應(yīng)后,硫元素以硫酸鹽的形式進入土壤中 B.機動車發(fā)動機的燃料燃燒時,高溫條件使空氣中的氮氣與氧氣反應(yīng),生成氮氧化物 C.節(jié)能不是簡單地減少能源的使用,更重要的是要充分有效地利用能源 D.中國天眼傳輸信息用的光導(dǎo)纖維材料的主要成分是硅 發(fā)布:2024/12/30 5:30:2組卷:27引用:2難度:0.9 -
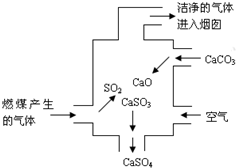 2.右圖是某燃煤發(fā)電廠處理廢氣的裝置示意圖.裝置內(nèi)發(fā)生的主要反應(yīng)中不含( )
2.右圖是某燃煤發(fā)電廠處理廢氣的裝置示意圖.裝置內(nèi)發(fā)生的主要反應(yīng)中不含( )A.化合反應(yīng) B.分解反應(yīng) C.置換反應(yīng) D.氧化還原反應(yīng) 發(fā)布:2024/12/30 4:0:1組卷:331引用:16難度:0.9 -
3.工業(yè)上常用微生物法、吸收法、電解法、還原法等消除硫、氮等引起的污染。
(1)微生物法脫硫
富含有機物的弱酸性廢水在SBR細菌作用下產(chǎn)生CH3COOH、H2等物質(zhì),可將廢水中還原為H2S,同時用N2或CO2將H2S從水中吹出,再用堿液吸收。SO2-4
①的空間構(gòu)型為SO2-4.
②CH3COOH與在SBR細菌作用下生成CO2和H2S的離子方程式為SO2-4.
③將H2S從水中吹出時,用CO2比N2效果更好,其原因是.
(2)吸收法脫硫
煙氣中的SO2可以用“亞硫酸銨吸收法”處理,發(fā)生的反應(yīng)為(NH4)2SO3+SO2+H2O═2NH4HSO3,測得25℃時溶液pH與各組分物質(zhì)的量分?jǐn)?shù)的變化關(guān)系如圖-1所示.b點時溶液pH=7,則n():n(NH+4)=HSO-3.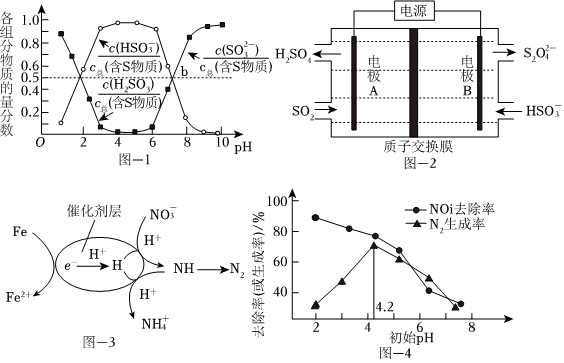
(3)電解法脫硫
用NaOH吸收后SO2,所得NaHSO3溶液經(jīng)電解后可制取Na2S2O4溶液,反應(yīng)裝置如圖-2所示。電解時每有1molS2生成有O2-4molH+透過質(zhì)子交換膜。
(4)還原法脫氮
用催化劑協(xié)同納米零價鐵去除水體中。其催化還原反應(yīng)的過程如圖-3所示。NO-3
①該反應(yīng)機理中生成N2的過程可描述為.
②過程中去除率及N2生成率如圖-4所示,為有效降低水體中氮元素的含量,宜調(diào)整水體pH為4.2,當(dāng)pH<4.2時,隨pH減小,N2生成率逐漸降低的原因是NO-3。發(fā)布:2024/12/30 5:30:2組卷:43引用:4難度:0.5
相關(guān)試卷


