2021年江蘇省高考化學聯考試卷(3月份)
發布:2024/4/20 14:35:0
一、選擇題(本題共11小題,每小題3分,共39分。每小題只有一個選項最符合題意)
-
1.習總書記提出:“綠水青山就是金山銀山”。下列做法恰當的是( )
A.大量使用化肥和農藥 B.田間秸稈就地焚燒 C.垃圾分類回收利用 D.推廣使用一次性塑料袋 組卷:15引用:1難度:0.9 -
2.鈦合金具有耐壓耐腐蝕性質,是重要的金屬材料,反應4Na+TiCl4
4NaCl+Ti可以制取金屬鈦。下列有關說法正確的是( )高溫A.鈉原子的結構示意圖: 
B.質子數為22、中子數為30的鈦原子: Ti3022C.TiCl4的電子式: 
D.Ti晶體為金屬晶體 組卷:20引用:1難度:0.7 -
3.疫情嚴重期間,為阻止新冠肺炎傳染,使用了大量“84”消毒液。實驗室用如圖所示裝置制備NaClO溶液,下列說法正確的是( )
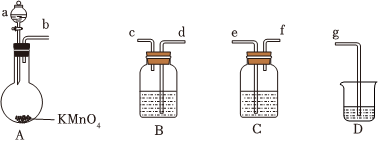
A.儀器接口的連接順序為b→c→d→e→f→g B.裝置B中試劑為濃硫酸 C.A中反應的離子方程式為2 +16H++10Cl-═2Mn2++5Cl2↑+8H2OMnO-4D.D中試劑可以是澄清石灰水 組卷:36引用:5難度:0.5 -
4.閱讀下列資料,完成4~6題:
工業制備硫酸的過程為:(1)利用含硫礦石或硫黃煅燒生成SO2;(2)SO2催化氧化生成SO3,反應為2SO2(g)+O2(g)?2SO3(g);(3)用98.3%的濃硫酸來吸收SO3。實驗室用濃硫酸和銅在加熱條件下反應制取少量SO2。
下列有關SO2的說法正確的是( )A.SO2的空間構型為直線形 B.SO2與H2O之間可能會形成氫鍵 C.SO2可以漂白酸性KMnO4溶液 D.SO2只有還原性,無氧化性 組卷:10引用:0難度:0.50 -
5.閱讀下列資料,完成4~6題:
工業制備硫酸的過程為:(1)利用含硫礦石或硫黃煅燒生成SO2;(2)SO2催化氧化生成SO3,反應為2SO2(g)+O2(g)?2SO3(g);(3)用98.3%的濃硫酸來吸收SO3。實驗室用濃硫酸和銅在加熱條件下反應制取少量SO2。
下列有關SO2催化氧化反應的說法正確的是( )A.其他條件相同時,只增加SO2的量,可以提高SO2平衡轉化率. B.反應的△H═E(SO2)+E(O2)-E(SO3)(E表示能量) C.一定溫度下,反應2SO2(g)+O2(g)?2SO3(g)可以自發進行,該反應的△H<0 D.在容器中通入2mol SO2和1mol O2充分反應,轉移電子數等于4×6.02×1023 組卷:5引用:0難度:0.50
-
16.重金屬離子會對人體造成危害,需回收利用。
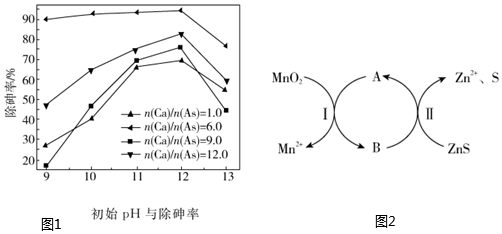
(1)在硫酸廢水中加入亞鐵鹽(FeSO4)和石灰,再通過充分曝氣氧化,將大部分Fe2+氧化為Fe3+大部分的AsO2-轉變成AsO43-,生成具有較小溶解度的砷酸鐵渣沉淀。
①AsO2-轉變成AsO43-的離子方程式為
②當pH大于12后,除砷率整體呈現下降的趨勢(如圖1),其原因是
③檢驗溶液中有Fe2+的方法是
(2)已知:反應的離子方程式為ZnS+MnO2+4H+═Zn2++Mn2++S+2H2O。具體轉化如圖2。溶液中加入Fe3+可以促進反應的發生,反應過程可描述為
(3)銅制印刷電路板蝕刻液的選擇及再生回收是研究熱點。用堿性CuCl2溶液(用NH3?H2O-NH4Cl調節pH)作蝕刻液,CuCl2+4NH3?H2O═Cu(NH3)4Cl2+4H2O;Cu(NH3)4Cl2+Cu═2Cu(NH3)2Cl。pH約為8.3~9.0的效果最好,其原因是。組卷:21引用:1難度:0.7 -
17.有機物F是一種重要的藥物合成中間體,F的合成路線如圖所示。

已知:
(1)有機物A的化學名稱是,F中官能團的名稱是。
(2)試劑a的結構簡式為,其核磁共振氫譜顯示組峰。
(3)反應⑤的反應類型為。
(4)反應④的化學方程式是,滿足下列條件的F的同分異構體有種。
①分子中含有兩個苯環結構;
②在酸性條件下能水解生成兩種產物且相對分子質量相等。
(5)參照上述合成路線,以乙醇為原料(無機試劑任選),設計制備聚2-丁烯( )的合成路線:組卷:33引用:3難度:0.5
)的合成路線:組卷:33引用:3難度:0.5


