 酸性KMnO4溶液與H2C2O4溶液的反應(yīng)通常用來研究濃度對反應(yīng)速率的影響。
酸性KMnO4溶液與H2C2O4溶液的反應(yīng)通常用來研究濃度對反應(yīng)速率的影響。
現(xiàn)有甲、乙兩個(gè)實(shí)驗(yàn)小組設(shè)計(jì)不同的實(shí)驗(yàn)方案如下:
甲組:改變反應(yīng)物的濃度,通過溶液褪色的時(shí)間來比較反應(yīng)速率快慢。
可以使用的試劑有:①0.2mol/L H2C2O4溶液、②0.4mol/L H2C2O4溶液、
③0.02mol/L H2C2O4溶液、④0.1mol/L KMnO4酸性溶液、⑤0.01mol/L KMnO4酸性溶液
(1)酸性KMnO4溶液與H2C2O4溶液反應(yīng)的化學(xué)反應(yīng)方程式為:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O;
(2)若假設(shè):所用草酸溶液與高錳酸鉀溶液體積比為1:2,請從上面的五種溶液中選擇本
實(shí)驗(yàn)所需的三種溶液(填寫序號(hào))①②⑤①②⑤;
(3)問題討論:已知該實(shí)驗(yàn)過程中溶液溫度幾乎不變,但是依據(jù)實(shí)驗(yàn)數(shù)據(jù)發(fā)現(xiàn)開始一段時(shí)
間后速率卻在增大。
①你認(rèn)為引起該反應(yīng)速率增大的因素是Mn2+對高錳酸鉀和草酸的反應(yīng)有催化作用Mn2+對高錳酸鉀和草酸的反應(yīng)有催化作用。
②欲設(shè)計(jì)實(shí)驗(yàn)確認(rèn),設(shè)計(jì)實(shí)驗(yàn)如表:
| 實(shí)驗(yàn) 編號(hào) |
X mol/LKMnO4酸性溶液/mL | Y mol/LH2C2O4溶液/mL | MnSO4溶液 /mL |
褪色時(shí)間/s |
| 1 | 4mL | 2mL | a | |
| 2 | b | c | 0mL |
蒸餾水
蒸餾水
,體積為:a
a
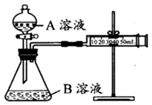
mL乙組:通過測定不同濃度的溶液生成CO2氣體體積的方法來比較化學(xué)反應(yīng)速率的大小。實(shí)驗(yàn)裝置如圖,實(shí)驗(yàn)時(shí)分液漏斗中A溶液一次性放入B溶液中已知乙組完成兩次實(shí)驗(yàn)分別是Ⅰ、Ⅱ.請完成以下各空:
(4)如何檢查該裝置的氣密性:
關(guān)閉分液漏斗活塞,向外拉注射器的內(nèi)管一段距離后松手,若內(nèi)管能回到開始位置,證明氣密性好,若不能則說明氣密性不好;
關(guān)閉分液漏斗活塞,向外拉注射器的內(nèi)管一段距離后松手,若內(nèi)管能回到開始位置,證明氣密性好,若不能則說明氣密性不好;
。(5)分析所給實(shí)驗(yàn)儀器,實(shí)現(xiàn)該實(shí)驗(yàn)?zāi)康倪€欠缺的用品:
秒表
秒表
。【考點(diǎn)】探究溫度、壓強(qiáng)對化學(xué)反應(yīng)速率的影響.
【答案】2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O;①②⑤;Mn2+對高錳酸鉀和草酸的反應(yīng)有催化作用;蒸餾水;a;關(guān)閉分液漏斗活塞,向外拉注射器的內(nèi)管一段距離后松手,若內(nèi)管能回到開始位置,證明氣密性好,若不能則說明氣密性不好;;秒表
【解答】
【點(diǎn)評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:36引用:2難度:0.5
相似題
-
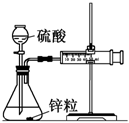 1.可以利用如圖所示的裝置測定不同濃度的硫酸與鋅的反應(yīng)速率.
1.可以利用如圖所示的裝置測定不同濃度的硫酸與鋅的反應(yīng)速率.
請回答下列問題:
(1)用上述裝置測定不同濃度的硫酸與鋅的反應(yīng)速率時(shí),必須要求實(shí)驗(yàn)裝置氣密性良好,檢查該裝置氣密性的方法是.
(2)按照上述裝置圖組裝3套相同的裝置,并檢查裝置氣密性,首先將注射器推至0刻度處,然后在三個(gè)錐形瓶中分別放入相同形狀的鋅粒2g,最后通過分液漏斗在錐形瓶中分別加入1mol/L,2mol/L和4mol/L的稀硫酸40mL.
請?zhí)顚懴铝斜碇锌瞻祝?br />
請選擇一組合適的數(shù)據(jù)填寫在第②組實(shí)驗(yàn)中的a,b處序號(hào) 加入的稀硫酸濃度 反應(yīng)時(shí)間/min 收集的氣體/mL 反應(yīng)速率/mL?min-1 ① 1mol/L 11 10 ② 2mol/L a 10 b ③ 4mol/L
10 5.0
A.12和0.83 B.6和1.67
C.1和10 D.6和3.67
(3)如果將錐形瓶用熱水浴加熱,則收集10mL氫氣的時(shí)間將.發(fā)布:2024/6/27 10:35:59組卷:32引用:1難度:0.9 -
2.某同學(xué)利用鐵與鹽酸的反應(yīng),探究影響反應(yīng)速率的因素(實(shí)驗(yàn)所用鐵的質(zhì)量相等且鐵塊的形狀相同,鹽酸均過量),實(shí)驗(yàn)設(shè)計(jì)如表:
回答下列問題:實(shí)驗(yàn)編號(hào) 鹽酸濃度/(mol?L-1) 鐵的狀態(tài) 溫度/K 1 2.00 塊狀 293 2 4.00 塊狀 293 3 4.00 粉末 293 4 4.00 塊狀 313
(1)若四組實(shí)驗(yàn)均以收集到448mL(標(biāo)準(zhǔn)狀況)氫氣為標(biāo)準(zhǔn),則上述實(shí)驗(yàn)中還需要測定的數(shù)據(jù)是。
(2)實(shí)驗(yàn)1和2是探究對該反應(yīng)速率的影響;實(shí)驗(yàn)和是探究溫度對該反應(yīng)速率的影響。
(3)根據(jù)實(shí)驗(yàn)測得的在不同時(shí)間t產(chǎn)生氫氣體積V的數(shù)據(jù),繪制得到圖甲,則曲線c對應(yīng)的實(shí)驗(yàn)組別可能是。根據(jù)實(shí)驗(yàn)數(shù)據(jù),該同學(xué)發(fā)現(xiàn)對于每一組實(shí)驗(yàn),產(chǎn)生氫氣的速率υ隨時(shí)間t變化情況如圖乙所示,其中t1~t2速率變化的主要原因是。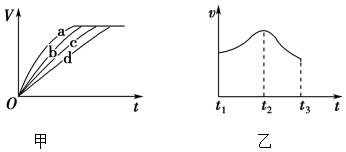
(4)若上述實(shí)驗(yàn)所用鹽酸體積均為250mL,實(shí)驗(yàn)3反應(yīng)進(jìn)行2min時(shí)收集到448mL(標(biāo)準(zhǔn)狀況)氫氣,反應(yīng)后溶液體積不變,則該條件下,該時(shí)間段內(nèi),以鹽酸的濃度變化表示的平均反應(yīng)速率v(HCl)=。發(fā)布:2024/6/27 10:35:59組卷:61引用:2難度:0.7 -
3.如表是研究性學(xué)習(xí)小組研究影響過氧化氫(H2O2)分解速率的因素時(shí)采集的一組數(shù)據(jù):用10mL H2O2溶液制取150mL氧氣所需的時(shí)間(單位:s)
請回答下列問題:
濃 度
反應(yīng)條件30% H2O2 15% H2O2 10% H2O2 5% H2O2 無催化劑、不加熱 幾乎不反應(yīng) 幾乎不反應(yīng) 幾乎不反應(yīng) 幾乎不反應(yīng) 無催化劑、加 熱 360 480 540 720 MnO2催化劑、加熱 10 25 60 120
(1)該研究小組在設(shè)計(jì)方案時(shí),考慮了濃度、、等反應(yīng)條件對過氧化氫分解速率的影響.
(2)從上述影響過氧化氫分解速率的三個(gè)因素說明這些因素對分解速率有何影響?;;.發(fā)布:2024/6/27 10:35:59組卷:38引用:6難度:0.5


