Na2SO3、NaHSO3是常見的化工原料,常用作還原劑。
(1)25℃,H2SO3、HSO-3、SO2-3的物質(zhì)的量分數(shù)[n(某微粒)n(H2SO3)+n(HSO-3)+n(SO2-3)]與pH的關(guān)系如圖所示。
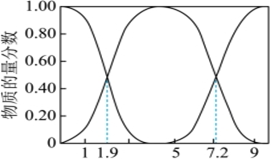
①若向NaOH溶液中通入SO2制取NaHSO3溶液,則當溶液的pH為 55時應(yīng)停止通入。
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是 c(Na+)+c(H+)=c(OH-)+c(HSO-3)+2c(SO2-3)c(Na+)+c(H+)=c(OH-)+c(HSO-3)+2c(SO2-3)(用溶液中所含微粒的物質(zhì)的量濃度表示)。
③NaHSO3溶液的酸堿性:酸性酸性。
④若測得25℃時,某溶液中c(SO2-3)c(H2SO3)═10,則溶液的pH為 5.055.05。
(2)Na2SO3固體久置后會被氧化,為測定某久置Na2SO3固體中Na2SO3的含量,現(xiàn)進行如下實驗:稱取0.3000g該固體于錐形瓶中,加水溶解后,邊振蕩邊向其中滴加0.1000mol?L-1I2標準溶液28mL,充分反應(yīng)后,向溶液中滴加2滴淀粉溶液作指示劑,繼續(xù)滴加0.1000mol?L-1Na2S2O3標準溶液與過量的I2反應(yīng)(發(fā)生反應(yīng)I2+2Na2S2O3═2NaI+Na2S4O6),恰好完全反應(yīng)時消耗Na2S2O3標準溶液16mL。
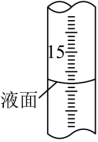
①如何判斷滴定終點:當?shù)稳胱詈笠坏瘟虼蛩徕c溶液時,溶液由藍色變?yōu)闊o色,且半分鐘內(nèi)不恢復(fù)說明達到滴定終點當?shù)稳胱詈笠坏瘟虼蛩徕c溶液時,溶液由藍色變?yōu)闊o色,且半分鐘內(nèi)不恢復(fù)說明達到滴定終點。
②滴定過程中,滴定管液面如圖所示,此時滴定管的讀數(shù)為 15.8015.80mL。
③計算久置Na2SO3固體中Na2SO3的質(zhì)量分數(shù)為 84%84%。
④下列情況會造成樣品中Na2SO3含量測定結(jié)果偏低的是 BCBC(填序號)。
A.滴定過程中用蒸餾水沖洗錐形瓶瓶壁
B.裝Na2S2O3標準溶液的滴定管水洗后未潤洗
C.開始滴定時,滴定管尖嘴部分未充滿液體
D.滴定前仰視讀數(shù),滴定后俯視讀數(shù)
HSO
-
3
SO
2
-
3
n
(
某微粒
)
n
(
H
2
S
O
3
)
+
n
(
HS
O
-
3
)
+
n
(
S
O
2
-
3
)
HSO
-
3
SO
2
-
3
HSO
-
3
SO
2
-
3
c
(
S
O
2
-
3
)
c
(
H
2
S
O
3
)
【答案】5;c(Na+)+c(H+)=c(OH-)+c()+2c();酸性;5.05;當?shù)稳胱詈笠坏瘟虼蛩徕c溶液時,溶液由藍色變?yōu)闊o色,且半分鐘內(nèi)不恢復(fù)說明達到滴定終點;15.80;84%;BC
HSO
-
3
SO
2
-
3
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/9/14 7:0:10組卷:3引用:1難度:0.6
相似題
-
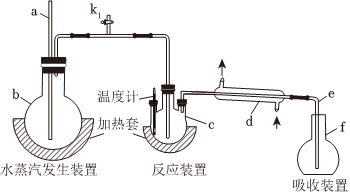 1.為測定某氟化稀土樣品中氟元素的質(zhì)量分數(shù)進行如下實驗。利用高氯酸(高沸點酸)將樣品中的氟元素轉(zhuǎn)化為氟化氫(低沸點酸)蒸出,再通過滴定測量,實驗裝置如圖所示。(1)a的作用是 ,f儀器的名稱是(2)檢查裝置氣密性:首先(填操作),關(guān)閉k1,微熱c,f中有氣泡冒出;停止加熱,導(dǎo)管e內(nèi)形成一段穩(wěn)定的水柱,說明裝置氣密性良好。(3)c中加入一定體積高氯酸和mg氟化稀土樣品,f中盛有滴加酚酞的NaOH溶液。加熱b、c,使水蒸氣進入c。①下列物質(zhì)可代替高氯酸的是(填序號)A.硝酸 B.鹽酸 C.硫酸 D.磷酸②實驗中除有HF氣體外,可能還有少量SiF4(易水解)氣體生成,若有SiF4生成,實驗結(jié)果將(填“偏高”“偏低”或”不受影響”)。③若觀察到f中溶液紅色褪去,需要向f中及時補加NaOH溶液,否則會使實驗結(jié)果偏低,原因是。(4)向餾出液中加入V1mL c1 mol/L La(NO3)3溶液,得到LaF3沉淀,再用c2mol/L EDTA標準溶液滴定剩余的La3+(La3+與EDTA按1:1絡(luò)合),消耗EDTA標準溶液V2 mL,則氟化稀土樣品中氟的質(zhì)量分數(shù)為。(F的相對原子質(zhì)量為19)(5)用樣品進行實驗前,需要用0.084g氟化鈉代替樣品進行實驗,改變條件(高氯酸用量、反應(yīng)溫度、蒸餾實驗),測量并計算出氟元素質(zhì)量,重復(fù)多次。該操作的目的是。發(fā)布:2025/1/18 8:0:1組卷:24引用:1難度:0.5
1.為測定某氟化稀土樣品中氟元素的質(zhì)量分數(shù)進行如下實驗。利用高氯酸(高沸點酸)將樣品中的氟元素轉(zhuǎn)化為氟化氫(低沸點酸)蒸出,再通過滴定測量,實驗裝置如圖所示。(1)a的作用是 ,f儀器的名稱是(2)檢查裝置氣密性:首先(填操作),關(guān)閉k1,微熱c,f中有氣泡冒出;停止加熱,導(dǎo)管e內(nèi)形成一段穩(wěn)定的水柱,說明裝置氣密性良好。(3)c中加入一定體積高氯酸和mg氟化稀土樣品,f中盛有滴加酚酞的NaOH溶液。加熱b、c,使水蒸氣進入c。①下列物質(zhì)可代替高氯酸的是(填序號)A.硝酸 B.鹽酸 C.硫酸 D.磷酸②實驗中除有HF氣體外,可能還有少量SiF4(易水解)氣體生成,若有SiF4生成,實驗結(jié)果將(填“偏高”“偏低”或”不受影響”)。③若觀察到f中溶液紅色褪去,需要向f中及時補加NaOH溶液,否則會使實驗結(jié)果偏低,原因是。(4)向餾出液中加入V1mL c1 mol/L La(NO3)3溶液,得到LaF3沉淀,再用c2mol/L EDTA標準溶液滴定剩余的La3+(La3+與EDTA按1:1絡(luò)合),消耗EDTA標準溶液V2 mL,則氟化稀土樣品中氟的質(zhì)量分數(shù)為。(F的相對原子質(zhì)量為19)(5)用樣品進行實驗前,需要用0.084g氟化鈉代替樣品進行實驗,改變條件(高氯酸用量、反應(yīng)溫度、蒸餾實驗),測量并計算出氟元素質(zhì)量,重復(fù)多次。該操作的目的是。發(fā)布:2025/1/18 8:0:1組卷:24引用:1難度:0.5 -
2.煤氣化是有效利用化石能源手段之一,有關(guān)反應(yīng)如下:
①C+H2OCO+H2 ②CO+H2O高溫CO2+H2一定條件
獲得的氣體稱為水煤氣。某研究性學習小組為探究氣體的成分進行了如下實驗:
[實驗]使水蒸氣通過灼熱的焦炭,收集反應(yīng)后流出的氣體。
[提出假設(shè)]對氣體的成分提出了三種假設(shè)。
假設(shè)1:該氣體是 CO、H2。
假設(shè)2:該氣體是 CO、H2、H2O。
(1)假設(shè)3:。
[設(shè)計實驗方案,驗證假設(shè)]
他們擬用下圖中提供的儀器,選擇必要的試劑,設(shè)計一個實驗,驗證上述假設(shè)(加熱裝置和導(dǎo)管等在圖中略去,實驗前裝置內(nèi)部的空氣已經(jīng)排盡)。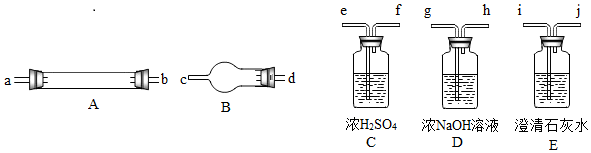
(2)按氣流從左至右連接各儀器,用題中小寫字母表示接口的連接順序(儀器可重復(fù)使用):
混合氣→dc→→→ij→→→→ij;
(3)儀器A中需加入試劑的是,其中反應(yīng)的化學方程式是;
(4)儀器B中需加入試劑的名稱是,其作用是;
[思考與交流]
(5)本實驗的尾氣需要處理,處理的方法為。
(6)某同學認為增加焦炭的量可以提高化學反應(yīng)①的速率,你是否同意他的說法,并簡述理由。發(fā)布:2024/12/30 14:0:1組卷:34引用:4難度:0.5 -
3.為探究礦石樣品X(僅含兩種元素)的組成和性質(zhì),某同學設(shè)計并完成如圖實驗:
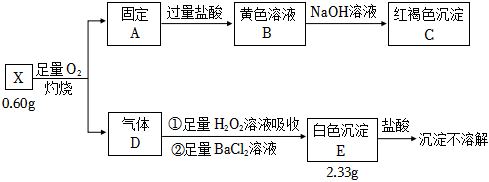
請回答:
(1)X含有的元素。
(2)X的化學式。
(3)紅褐色沉淀C是。
(4)氣體D通入足量H2O2中發(fā)生反應(yīng)①的化學方程式。發(fā)布:2024/12/30 14:30:1組卷:15引用:3難度:0.7
相關(guān)試卷


