2022-2023學年重慶市萬州二中高二(上)月考化學試卷(12月份)
發(fā)布:2024/9/14 7:0:10
一、單選題(每個4分,共4×16==64分)
-
1.下列事實:
①NaHSO4溶液呈酸性;
②長期施用化肥(NH4)2SO4會使土壤酸性增強,發(fā)生板結;
③配制CuCl2溶液時,用稀鹽酸溶解CuCl2固體;
④NaHS溶液中c(H2S)>c(S2-);
⑤明礬凈水;
⑥蒸干FeCl3溶液,往往得不到FeCl3固體。
其中與鹽類的水解有關的有( )A.僅②③⑤ B.僅②③④⑤⑥ C.僅①②③④⑤⑥ D.僅②③④⑤ 組卷:14引用:2難度:0.7 -
2.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.1LpH=1的H2SO4溶液中,所含的H+離子總數為0.2NA B.1L0.1mol?L-1FeCl3溶液中,所含的陽離子總數大于0.1NA C.一定條件下,在某一恒容密閉容器中,0.1molN2和0.3molH2充分反應后,生成的NH3分子總數為0.2NA D.0.5L0.1mol?L-1HNO2溶液中,所含的HNO2分子總數為0.05NA 組卷:65引用:6難度:0.5 -
3.下列有關實驗內容、實驗裝置和對應的實驗目的均正確的是( )
A B C D 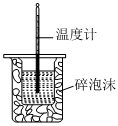
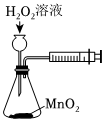
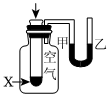
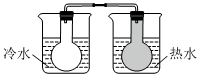
將NO2球浸泡在冷水和熱水中測定中和熱 測定O2的生成速率 驗證反應的吸放熱 比較溫度對反應速率的影響 A.A B.B C.C D.D 組卷:25引用:5難度:0.6 -
4.下列說法不正確的是( )
A.恒溫恒壓下,ΔH<0且ΔS>0的反應正向能自發(fā)進行 B.相同物質的量的同種物質氣態(tài)時熵值最大,固態(tài)時熵值最小 C.反應NH3(g)+HCl(g)═NH4Cl(s)在室溫下可自發(fā)進行,則該反應的ΔH<0 D.非自發(fā)的反應一定可以通過改變條件使其成為自發(fā)反應 組卷:17引用:2難度:0.7 -
5.下列依據熱化學方程式得出的結論正確的是( )
A.已知2SO2(g)+O2(g)?2SO3(g)ΔH<0,則SO2的能量一定高于SO3的能量 B.已知C(石墨,s)═C(金剛石,s)ΔH>0,則金剛石比石墨穩(wěn)定 C.已知H+(aq)+OH-(aq)═H2O(l)ΔH═-57.3kJ?mol-1,則任何酸堿中和反應的熱效應均為57.3kJ D.已知2C(s)+2O2(g)═2 CO2(g)ΔH1;2C(s)+O2(g)═2CO (g)ΔH2,則ΔH1<ΔH2 組卷:49引用:3難度:0.6 -
6.為達到相應實驗目的,下列實驗操作可行的是( )
編號 實驗目的 實驗操作 A 證明碳酸酸性強于硼酸 向飽和碳酸氫鈉溶液中滴加少量的硼酸溶液,無氣泡產生 B 證明HClO是弱電解質 用pH試紙測NaClO溶液的pH值 C 除去堿式滴定管內的氣泡 將尖嘴垂直向下,擠壓膠管內玻璃球將氣泡排出 D 證明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] 向10mL0.2mol?L-1NaOH溶液中滴入2滴0.1mol?L-1MgCl2溶液,產生白色沉淀后,再滴加2滴0.1mol?L-1FeCl3溶液,出現紅褐色沉淀 A.A B.B C.C D.D 組卷:8引用:3難度:0.5
二、非選擇題
-
17.(1)下列物質中,屬于電解質的是
,屬于強電解質的是,屬于弱電解質的是(填序號)。
①H2SO4 ②鹽酸 ③硫酸鋇 ④乙醇 ⑤銅 ⑥H2S ⑦蔗糖 ⑧氨氣 ⑨NH4HSO3
(2)甲醇是重要的化工原料,利用合成氣(主要成分為CO、CO2和H2)在催化劑作用下合成甲醇,相關反應的熱化學方程式及平衡常數如下所示:
ⅰ.CO+2H2?CH3OH ΔH=akJ?mol-1 K1
ⅱ.CO+3H2?CH3OH+H2O ΔH=bkJ?mol-1 K2
ⅲ.CO+H2?CO+H2O ΔH=ckJ?mol-1 K3
回答下列問題:
①a═(用b、c表示),則K1═(用K2、K3表示)。
②在一定溫度下,向體積為1L的恒容密閉容器中通入等物質的量的CO2和H2,在催化劑的作用下僅發(fā)生反應ⅲ.下列敘述能表示該反應達到平衡狀態(tài)的是(填標號)。
a.容器中混合氣體的壓強不再改變
b.容器中CO、CO2的物質的量相等
c.容器中氣體的密度不再改變
d.相同時間內,斷裂H-O的數目是斷裂H-H的2倍
(3)在密閉容器中充入一定量的CO和NO氣體,發(fā)生反應2CO(g)+2NO(g)?2CO2(g)+N2(g)ΔH<0,如圖為平衡時NO的體積分數與溫度、壓強的關系: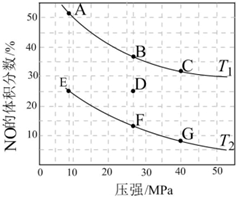
①溫度:T1T2 (填“>”、“<”或“═”)。
②若在D點對應容器升溫,同時擴大體積使體系壓強減小,重新達到的平衡狀態(tài)可能是圖中A~G點中的點(填字母)。組卷:4引用:1難度:0.7 -
18.Na2SO3、NaHSO3是常見的化工原料,常用作還原劑。
(1)25℃,H2SO3、、HSO-3的物質的量分數[SO2-3]與pH的關系如圖所示。n(某微粒)n(H2SO3)+n(HSO-3)+n(SO2-3)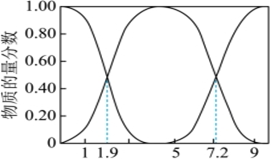
①若向NaOH溶液中通入SO2制取NaHSO3溶液,則當溶液的pH為時應停止通入。
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是(用溶液中所含微粒的物質的量濃度表示)。
③NaHSO3溶液的酸堿性:。
④若測得25℃時,某溶液中═10,則溶液的pH為c(SO2-3)c(H2SO3)。
(2)Na2SO3固體久置后會被氧化,為測定某久置Na2SO3固體中Na2SO3的含量,現進行如下實驗:稱取0.3000g該固體于錐形瓶中,加水溶解后,邊振蕩邊向其中滴加0.1000mol?L-1I2標準溶液28mL,充分反應后,向溶液中滴加2滴淀粉溶液作指示劑,繼續(xù)滴加0.1000mol?L-1Na2S2O3標準溶液與過量的I2反應(發(fā)生反應I2+2Na2S2O3═2NaI+Na2S4O6),恰好完全反應時消耗Na2S2O3標準溶液16mL。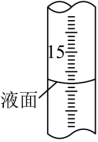
①如何判斷滴定終點:。
②滴定過程中,滴定管液面如圖所示,此時滴定管的讀數為mL。
③計算久置Na2SO3固體中Na2SO3的質量分數為。
④下列情況會造成樣品中Na2SO3含量測定結果偏低的是(填序號)。
A.滴定過程中用蒸餾水沖洗錐形瓶瓶壁
B.裝Na2S2O3標準溶液的滴定管水洗后未潤洗
C.開始滴定時,滴定管尖嘴部分未充滿液體
D.滴定前仰視讀數,滴定后俯視讀數組卷:3引用:1難度:0.6


