以黃鐵礦(主要成分FeS2)為原料生產硫酸,并將產出的爐渣和尾氣進行資源綜合利用,減輕對環境的污染,其中一種流程如圖所示。

(1)FeS2中鐵元素的化合價為 +2+2。
(2)“氧化”時,反應的化學方程式為 2SO2+O2催化劑△2SO32SO2+O2催化劑△2SO3。
(3)工業上,吸收SO3時宜選用的試劑X為 濃硫酸濃硫酸(填“水”或“濃硫酸”)。
(4)含SO2的尾氣用過量的NaOH溶液吸收。為得到用于制備焦亞硫酸鈉(Na2S2O5)的高純度NaHSO3,應再向吸收液中通入過量的 SO2SO2氣體。
(5)因為Na2S2O5在保存過程中發生 氧化氧化(填“氧化”或“還原”)反應,導致商品Na2S2O5中不可避免地存在 Na2SO4。欲檢驗其中的SO2-4,可取少量樣品溶于水中,先加入足量稀鹽酸,再加入BaCl2溶液,觀察到產生白色沉淀現象先加入足量稀鹽酸,再加入BaCl2溶液,觀察到產生白色沉淀現象,說明含有SO2-4。
(6)Na2S2O5可用于葡萄酒的抗氧化劑。用碘標準液可測定葡萄酒中Na2S2O5的殘留量,請配平該反應的方程式:11S2O2-5+22I2+33H2O═22SO2-4+44I-+66H+。
催化劑
△
催化劑
△
SO
2
-
4
SO
2
-
4
O
2
-
5
SO
2
-
4
【答案】+2;2SO2+O22SO3;濃硫酸;SO2;氧化;先加入足量稀鹽酸,再加入BaCl2溶液,觀察到產生白色沉淀現象;1;2;3;2;4;6
催化劑
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:31引用:1難度:0.5
相似題
-
1.硫酸在化工生產國民經濟發展中占有極其重要的地位,如圖是工業接觸法制硫酸的簡單流程圖。
試回答下列有關問題: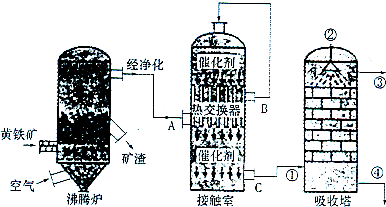
(1)寫出工業上用FeS2制取SO2的化學方程式;
(2)在硫酸工業生產過程中,需要考慮的因素很多,主要有生產原料的選擇與凈化反應條件和設備的選擇、;
(3)反應2SO2+O2?2SO3是在400~500℃條件下在接觸室中進行的,選擇這一反應條件的理由是在,在實際生產過程中進入接觸室的氣體中O2的體積分數是SO2體積分數的1.5倍,其原因是;
(4)硫酸工廠形成的“三廢”對環境有較大的影響,處理硫酸工廠尾氣的化學方程式是;
(5)下圖所示的裝置是仿照工業制備硫酸的工藝流程設計出來的,用于探究工業上為何采用98.3%的濃硫酸吸收三氧化硫;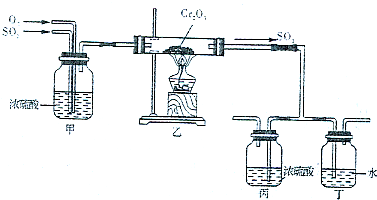
①若丁裝置在反應過程中出現氣泡,不久就出現了自霧,而丙裝置一直沒有明顯變化,丁裝置產生白霧的原因是,此現象對工業上制硫酸帶來的不良后果是;
②上圖中的乙裝置和丙裝置分別與工業制取硫酸的某個裝置相對應,其中乙裝置對應的是接觸室; 丙裝置對應的是。發布:2024/12/30 6:0:2組卷:12引用:2難度:0.5 -
2.關于工業上用接觸法制硫酸的說法不正確的是( )
A.硫酸廠應建在靠近原料產地的地區 B.主要設備有沸騰爐、接觸室和吸收塔 C.三氧化硫不用水吸收,而是用濃硫酸吸收 D.尾氣若不經處理排放,有可能形成硫酸型酸雨 發布:2024/12/30 5:30:2組卷:28引用:3難度:0.7 -
3.有關接觸法制硫酸的敘述.其中不正確的是( )
A.用硫黃或含硫礦石均可作為原料 B.尾氣含有二氧化硫,在排入大氣前需進行凈化處理 C.接觸法制硫酸分為三個流程:硫黃或黃鐵礦→SO2;SO2→SO3;SO3→H2SO4 D.接觸法制硫酸的三個階段都在接觸室進行 發布:2024/12/30 6:0:2組卷:26引用:3難度:0.7


