亞硝酸鈉味工業、建筑業中廣為使用,某同學對亞硝酸鈉進行相關研究。
(一)查閱資料:
ⅰ.亞硝酸鈉(NaNO2)固體為白色咸味固體,溶于水為無色溶液。
ⅱ.亞硝酸(HNO2)是一元弱酸,酸性比醋酸略強,具有不穩定性,易分解生成NO和NO2;能被常見的氧化劑氧化;在酸性條件下,它也具有較強氧化性,如能把I-氧化成I2,本身被還原為NO氣體。
ⅲ.AgNO2是一種微溶于水、易溶于酸的淺黃色固體。
(二)解決問題:
(1)亞硝酸分解的反應方程式:2HNO2=H2O+NO↑+NO2↑2HNO2=H2O+NO↑+NO2↑;酸性條件下,亞硝酸鈉溶液和碘化鉀溶液混合反應的離子方程式:2HNO2+2I-+2H+=I2+2NO↑+2H2O2HNO2+2I-+2H+=I2+2NO↑+2H2O。
(2)由于亞硝酸鈉和食鹽性狀相似,難以分辨,曾多次發生過將NaNO2誤當食鹽食用的事件。鑒別NaNO2和NaCl兩種溶液的實驗操作和現象:取少量溶于水得到溶液,加入HNO3酸化的AgNO3溶液,若出現白色沉淀,說明為NaCl,無白色沉淀說明為NaNO2取少量溶于水得到溶液,加入HNO3酸化的AgNO3溶液,若出現白色沉淀,說明為NaCl,無白色沉淀說明為NaNO2。
(三)實驗測定
為了測定樣品中NaNO2的含量,某同學進行如下實驗:①稱取樣品wg,加水溶解,配制成100mL溶液。②取25.00mL溶液于錐形瓶中,用0.0200mol?L-1KMnO4標準溶液(酸性)進行滴定,滴定結束后消耗KMnO4溶液VmL。
(3)上述實驗①所需玻璃儀器除玻璃棒、膠頭滴管之外還需要 燒杯、100 mL容量瓶燒杯、100 mL容量瓶。
(4)在進行滴定操作時,KMnO4溶液盛裝在 酸式酸式(填“酸式”或“堿式”)滴定管中。達到滴定終點的現象是 錐形瓶中無色溶液變成粉紅色,且30s內不褪色;錐形瓶中無色溶液變成粉紅色,且30s內不褪色;。
(5)滴定過程中發生反應的離子方程式是 5NO-2+2MnO-4+6H+=5NO-3+2Mn2++3H2O5NO-2+2MnO-4+6H+=5NO-3+2Mn2++3H2O;測得該樣品中NaNO2的質量分數為 1.38Va%1.38Va%。(用w、v表示)
NO
-
2
M
n
O
-
4
NO
-
3
NO
-
2
M
n
O
-
4
NO
-
3
1
.
38
V
a
%
1
.
38
V
a
%
【考點】亞硝酸鹽;探究物質的組成或測量物質的含量.
【答案】2HNO2=H2O+NO↑+NO2↑;2HNO2+2I-+2H+=I2+2NO↑+2H2O;取少量溶于水得到溶液,加入HNO3酸化的AgNO3溶液,若出現白色沉淀,說明為NaCl,無白色沉淀說明為NaNO2;燒杯、100 mL容量瓶;酸式;錐形瓶中無色溶液變成粉紅色,且30s內不褪色;;5+2+6H+=5+2Mn2++3H2O;
NO
-
2
M
n
O
-
4
NO
-
3
1
.
38
V
a
%
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:4引用:1難度:0.7
相似題
-
1.HNO2是一種弱酸,且不穩定,易分解生成NO和NO2;它能被常見的強氧化劑氧化:在酸性溶液中它也是一種氧化劑,如能把Fe2+氧化成Fe3+。AgNO2是一種難溶于水、易溶于酸的化合物,試回答下列問題:
(1)人體正常的血紅蛋白含有Fe2+,若誤食亞硝酸鹽(如NaNO2),則導致血紅蛋白中的Fe2+轉化為Fe3+而中毒,服用維生素C可解毒。下列敘述不正確的是。(填字母)
A.亞硝酸鹽被還原
B.維生素C是還原劑
C.維生素C將Fe3+還原為Fe2+
D.亞硝酸鹽是還原劑
(2)某同學把新制的氯水加到NaNO2溶液中,觀察到氯水褪色,同時生成NaNO3和HCl,請寫出反應的離子方程式:。
(3)Fe與過量稀硫酸反應可以制取FeSO4,若用反應所得的酸性溶液,將Fe2+轉化為Fe3+,要求產物純凈,可選用的最佳試劑是。(填字母)
a.Cl2
b.Fe
c.H2O2
d.HNO3
(4)下列方法中,不能用來區分NaNO2和NaCl的是。(填字母)
A.測定兩溶液的pH
B.分別在兩溶液中滴加甲基橙
C.在酸性條件下加入淀粉碘化鉀溶液區別
D.用AgNO3和HNO3兩種試劑來區別
(5)FeSO4可用于制備一種新型、高效、多功能綠色水處理劑高鐵酸鉀(K2FeO4),氧化性比Cl2、O2、ClO2、KMnO4更強,主要反應:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,則:
①該反應中的氧化劑是,還原劑是。
②簡要說明K2FeO4作為水處理劑時所起的作用。發布:2024/6/27 10:35:59組卷:102引用:3難度:0.3 -
2.亞硝酸鈉是一種具有咸味、有毒的工業用鹽,工業上常用作防腐劑。
(1)NaNO2中N的化合價為,由N的化合價推測NaNO2具有(填“氧化性”、“還原性”或“氧化性、還原性”)。
(2)NaNO2易溶于水,水溶液顯堿性。寫出HNO2的電離方程式。
(3)酸性條件下,NO2-能與MnO4-反應得到NO3-,寫出此反應的離子方程式。
(4)NaNO2與HI反應:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,若有0.5mol氧化劑被還原,則被氧化的還原劑的物質的量是mol。
(5)工業廢水中含有亞硝酸鹽,以氯化銨處理亞硝酸鹽的新工藝已在工業上廣泛使用。該反應的生成物不會給環境帶來任何污染,寫出反應的離子方程式,理論上53.5kgNH4Cl可除去廢水中的NO2-mol。發布:2024/6/27 10:35:59組卷:20引用:1難度:0.7 -
3.SO2和NOx都是大氣污染物.
(1)空氣中的NO2可形成硝酸型酸雨,該反應的化學方程式是.
(2)汽車發動機工作時產生的NO和CO可通過催化轉化器轉化為兩種無污染的氣體,該反應的化學方程式是.
(3)利用氨水可以將SO2和NO2吸收,原理如下圖所示:NO2被吸收的離子方程式是.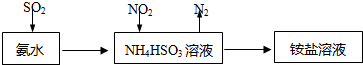
(4)利用下圖所示裝置(電極均為惰性電極)也可吸收SO2,并用陰極排出的溶液吸收NO2.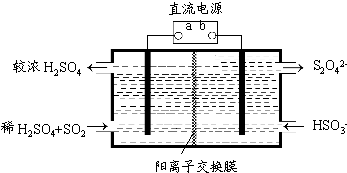
①a為電源的(填“正極”或“負極”),陽極的電極反應式為.
②在堿性條件下,用陰極排出的溶液吸收NO2,使其轉化為無害氣體,同時有SO32-生成.該反應中氧化劑與還原劑的物質的量之比為.發布:2024/6/27 10:35:59組卷:98引用:3難度:0.1


