碘酸鉀(KIO3)為白色固體,可溶于水,常作為補碘劑被添加到食鹽中。小組同學實驗探究其性質如下:
【實驗1】探究KIO3的熱穩定性。按如圖裝置完成實驗:
| 序號 | 1-1 | 1-2 |
| 裝置 |  |
 |
| 現象 | 加熱較長時間后,導管口持續產生氣泡 | a |
(1)食鹽中加碘可預防
甲狀腺
甲狀腺
疾病。(2)實驗1-1結束時,應進行的操作是先
從水中取出導管
從水中取出導管
,后 熄滅酒精燈
熄滅酒精燈
。(3)實驗1-2中a處現象為
帶火星的木條復燃
帶火星的木條復燃
,說明1-1中收集到的氣體是氧氣。由此證明碘酸鉀與氯酸鉀一樣受熱會分解且反應相似,請寫出碘酸鉀受熱分解的文字表達式 碘酸鉀碘化鉀+氧氣
加熱
碘酸鉀碘化鉀+氧氣
。加熱
【實驗2】探究KIO3與維生素C的反應及其影響因素。分別取不同濃度的碘酸鉀和維生素C溶液按下表進行實驗:
【查閱資料】
Ⅰ.淀粉溶液遇單質碘(I2)變為藍色,遇KIO3、維生素C、醋酸均不變色。
Ⅱ.單質碘受熱易升華;西蘭花、卷心菜、番茄等蔬菜中含有較豐富的維生素C;食醋中含有約3%的醋酸。
| 裝置 | 序號 | 溶液的濃度 | 實驗現象 | |
| 碘酸鉀 | 維生素 | |||
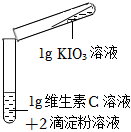 |
2-1 | 10% | 10% | 溶液立即由無色變為藍色 |
| 2-2 | 0.5% | 0.5% | 溶液慢慢由無色變為藍色 | |
| 2-3 | 0.25% | 0.25% | 一段時間后溶液無明顯變化,再滴入5滴稀醋酸后,溶液逐漸變為淺藍色 | |
(4)根據實驗中“KIO3溶液與維生素C溶液均不能使淀粉變藍色,但是兩者混合后淀粉變藍色”這一實驗現象可得出的結論是
KIO3能與維生素C反應生成I2
KIO3能與維生素C反應生成I2
。(5)對比實驗2-1、2-2,可探究的影響KIO3與維生素C反應的因素是
反應物的濃度
反應物的濃度
。(6)甲同學由實驗2-3得出結論:醋酸會促進KIO3與維生素C的反應。乙同學認為該結論不嚴謹,其理由是
有可能是醋酸和碘酸鉀反應生成了I2
有可能是醋酸和碘酸鉀反應生成了I2
;為此可補充實驗 取1g0.25%的碘酸鉀溶液,加入2滴淀粉溶液,再加入5滴稀醋酸,溶液沒有變藍,說明醋酸不能和碘酸鉀反應生成I2
取1g0.25%的碘酸鉀溶液,加入2滴淀粉溶液,再加入5滴稀醋酸,溶液沒有變藍,說明醋酸不能和碘酸鉀反應生成I2
(寫出實驗操作、現象和結論)。(7)由以上實驗可知:在使用添加了碘酸鉀的食鹽時,為減少碘的損失,除了要在菜起鍋時才加食鹽外還要
在烹調西蘭花、卷心菜、番茄等含有較豐富維生素C的蔬菜時不要加食醋
在烹調西蘭花、卷心菜、番茄等含有較豐富維生素C的蔬菜時不要加食醋
。【考點】實驗探究物質的性質或變化規律.
【答案】甲狀腺;從水中取出導管;熄滅酒精燈;帶火星的木條復燃;碘酸鉀碘化鉀+氧氣;KIO3能與維生素C反應生成I2;反應物的濃度;有可能是醋酸和碘酸鉀反應生成了I2;取1g0.25%的碘酸鉀溶液,加入2滴淀粉溶液,再加入5滴稀醋酸,溶液沒有變藍,說明醋酸不能和碘酸鉀反應生成I2;在烹調西蘭花、卷心菜、番茄等含有較豐富維生素C的蔬菜時不要加食醋
加熱
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/8/14 0:0:1組卷:32引用:2難度:0.4
相似題
-
1.碳酸氫鈉是一種應用廣泛的鹽,化學小組對其進行了探究。
(1)NaHCO3可稱為鈉鹽或碳酸氫鹽,它是由Na+和(填離子符號)構成,醫療上能用于治療胃酸(含有鹽酸)過多癥,反應的化學方程式為。
【提出問題】實驗室中如何制取少量NaHCO3?
【查閱資料】
材料一:侯氏制堿的原理:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3Na2CO3+CO2↑+H2O。△
材料二:研究發現,NaHCO3溶于水時吸收熱量,Na2CO3溶于水時放出熱量。
【實驗制備】根據侯氏制堿原理設計如圖1所示裝置制取NaHCO3。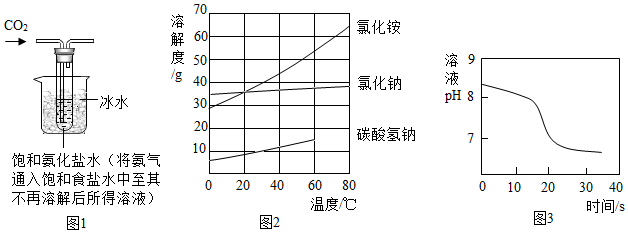
反應結束后,將試管中的混合物過濾洗滌,低溫烘干得白色固體。
(2)燒杯中冰水的作用是。
(3)能進一步確認該白色固體是NaHCO3的實驗方案是(須用到的儀器和藥品:試管、溫度計、水)。
(4)如圖2中碳酸氫鈉的溶解度在60℃后無數據的原因可能是。
【性質探究】
常溫下,取一定量的NaHCO3溶液于燒杯中,插入pH傳感器,向燒杯中持續滴加CaCl2溶液,有白色沉淀生成,當溶液的pH變為6.68時開始有無色氣體產生。反應過程中溶液的pH隨時間變化如圖3所示。
【查閱資料】
材料三NaHCO3溶于水后,少量的能同時發生如下變化:HCO-3
變化①:+H2O→H2CO3+OH-;HCO-3
變化②:→HCO-3+H+。CO2-3
材料四:溶液的酸堿性與溶液中H+和OH-數目的相對大小有關。常溫下,當單位體積溶液中OH-的數目大于H+的數目時溶液的pH>7,反之pH<7;單位體積溶液中所含的H+數目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液顯(填“酸”“堿”或“中”)性,結合材料三、四從微觀角度說明原因:。
(6)根據本實驗,下列說法錯誤的是(填字母)。
a.pH<6.68時生成的無色氣體為CO2
b.從0~30s,單位體積溶液中H+數目不斷增大
c.不能用CaCl2溶液鑒別Na2CO3和NaHCO3溶液發布:2024/12/25 15:30:1組卷:591引用:4難度:0.5 -
2.關于鹽的性質研究是一項重要的課題,某興趣小組以“探究碳酸氫鈉的性質”為主題開展項目式學習。
【任務一】認識碳酸氫鈉
(1)下列關于碳酸氫鈉的說法正確的是。
A.碳酸氫鈉是由Na+和構成HCO-3
B.碳酸氫鈉俗稱純堿
C.碳酸氫鈉醫療上能用于治療胃酸過多癥
D.碳酸氫鈉難溶于水
【任務二】探究碳酸氫鈉的性質
(2)探究碳酸氫鈉與稀鹽酸反應:興趣小組取適量碳酸氫鈉粉末于甲試管中,加入稀鹽酸,如圖1所示,觀察到甲試管中有氣泡產生,乙中,說明碳酸氫鈉能與稀鹽酸反應生成CO2,寫出試管甲中反應的化學方程式。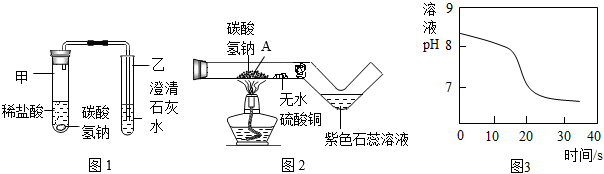
(3)探究碳酸氫鈉的熱穩定性:用酒精燈充分加熱玻璃管,如圖2所示。
資料:無水硫酸銅呈白色,遇水后呈藍色
①發現玻璃管內無水硫酸銅變藍,紫色石蕊溶液變紅,說明碳酸氫鈉受熱易分解,且有和二氧化碳生成。
②實驗后興趣小組同學猜想玻璃管A處固體產物僅是Na2CO3而不含有NaOH,請設計實驗證明(寫出具體步驟和現象):。
(4)常溫下,興趣小組同學取一定量的NaHCO3溶液于燒杯中,插入pH傳感器,向燒杯中持續滴加CaCl2溶液,有白色沉淀生成,當溶液的pH變為6.68時開始有無色氣體產生。反應過程中溶液的pH隨時間變化如圖3所示。
【查閱資料】
材料一:NaHCO3溶于水后,少量的能同時發生如下變化:HCO-3
變化①:+H2O→H2CO3+OH-HCO-3
變化②:→HCO-3+H+CO2-3
材料二:溶液的酸堿性與溶液中H+和OH-數目的相對大小有關。常溫下,當單位體積溶液中OH-的數目大于H+的數目時溶液的pH>7,反之pH<7;單位體積溶液中所含的H+數目越大,溶液的pH越小。
①根據上述實驗可知NaHCO3溶液顯堿性,結合材料一、二從微觀角度說明原因:。
②根據本實驗,可知從0~30s,單位體積溶液中H+數目不斷(填“增大”或“減小”)。發布:2024/12/25 17:0:2組卷:94引用:2難度:0.4 -
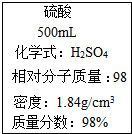 3.圖是一瓶濃硫酸標簽上的部分內容,某探究小組的同學對這瓶硫酸進行了如下探究,請你參與.
3.圖是一瓶濃硫酸標簽上的部分內容,某探究小組的同學對這瓶硫酸進行了如下探究,請你參與.
[查閱資料]濃硫酸有強腐蝕性,溶于水會放熱;硫酸鋇不溶于水也不溶于酸.
[探究一]濃硫酸稀釋時會放熱.
(1)稀釋濃硫酸時,所需儀器主要有,應如何稀釋濃硫酸?.測量稀釋前后溶液的溫度,有明顯升高的現象.結論:濃硫酸溶于水放熱.
[探究二]稀硫酸與氫氧化鈉溶液能發生反應.圖10
(2)稀硫酸與氫氧化鈉溶液反應的化學方程式為實驗步驟 實驗現象 實驗結論 先用pH試紙測定稀硫酸的pH,再逐滴加入氫氧化鈉溶液并不斷振蕩,同時測混合液的pH pH逐漸變大,
最后pH≥7稀硫酸與氫氧化鈉
溶液能發生反應.
(3)實驗中僅從溶液pH變大,而不強調pH≥7,不能得出稀硫酸與氫氧化鈉溶液一定發生反應的結論,理由是.
[探究三]由于該試劑瓶瓶口密封簽已破損,同學們懷疑該濃硫酸的質量分數與標簽不相符.
[提出問題]該濃硫酸的質量分數是否發生變化?
[實驗探究](4)取該濃硫酸和足量BaCl2溶液反應,過濾、洗滌、干燥沉淀.實驗中如何確定硫酸已完全反應.
(5)為達到實驗目的,實驗中必須要測知的數據是.
[探究結論](6)由實驗測得的數據計算出的硫酸的質量分數與標簽不符.該硫酸的質量分數應98%(填“大于”或“小于”).發布:2025/1/6 8:0:1組卷:38引用:1難度:0.5


