某探究小組用KMnO4酸性溶液與H2C2O4溶液反應過程中溶液紫色消失的方法,研究影響反應速率的因素。實驗條件作如下限定:所用KMnO4酸性溶液的濃度可選擇0.01mol?L-1、0.001mol?L-1,催化劑的用量可選擇0.5g、0g,實驗溫度可選擇298K、323K。
每次實驗KMnO4酸性溶液的用量均為4mL、H2C2O4溶液(0.1mol?L-1)的用量均為2mL。
(1)配平化學方程式:22KMnO4+55H2C2O4+33H2SO4→11K2SO4+22MnSO4+1010CO2+88H2O
(2)請完成如表實驗設計表,并在實驗目的一欄中填出對應的實驗編號:
| 實驗 編號 |
T/K | 催化劑的用量/g | KMnO4酸性溶液的濃度/mol?L-1 | 實驗目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)實驗①和②探究KMnO4酸性溶液的濃度對該反應速率的影響; (Ⅱ)實驗①和③探究溫度對該反應速率的影響; (Ⅲ)實驗①和④探究催化劑對該反應速率的影響 |
| ② | 298 298
|
0.5 0.5
|
0.001 0.001
|
|
| ③ | 323 323
|
0.5 0.5
|
0.01 0.01
|
|
| ④ | 298 | 0 | 0.01 |
①針對上述實驗現象,同學認為高錳酸鉀與草酸溶液的反應放熱,導致溶液溫度升高,反應速率加快,從影響化學反應速率的因素看,你猜想還可能是因為
生成的Mn2+催化反應的進行
生成的Mn2+催化反應的進行
。②若用實驗證明你的猜想。除酸性高錳酸鉀溶液,草酸溶液外,還需要選擇的試劑最合理的是
B
B
。A.硫酸鉀
B.硫酸錳
C.二氧化錳
D.水
(4)某同學對實驗①和②分別進行三次實驗,測得以下實驗數據(從混合振蕩均勻開始計時):
| KMnO4酸性溶液 的濃度/mol?L-1 |
溶液褪色所需時間 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
1×10-4mol?L-1?min-1
1×10-4mol?L-1?min-1
。(忽略混合前后溶液體積的變化)。【考點】探究溫度、壓強對化學反應速率的影響.
【答案】2;5;3;1;2;10;8;298;0.5;0.001;323;0.5;0.01;生成的Mn2+催化反應的進行;B;1×10-4mol?L-1?min-1
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網所有,未經書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:170引用:3難度:0.6
相似題
-
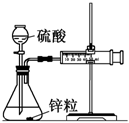 1.可以利用如圖所示的裝置測定不同濃度的硫酸與鋅的反應速率.
1.可以利用如圖所示的裝置測定不同濃度的硫酸與鋅的反應速率.
請回答下列問題:
(1)用上述裝置測定不同濃度的硫酸與鋅的反應速率時,必須要求實驗裝置氣密性良好,檢查該裝置氣密性的方法是.
(2)按照上述裝置圖組裝3套相同的裝置,并檢查裝置氣密性,首先將注射器推至0刻度處,然后在三個錐形瓶中分別放入相同形狀的鋅粒2g,最后通過分液漏斗在錐形瓶中分別加入1mol/L,2mol/L和4mol/L的稀硫酸40mL.
請?zhí)顚懴铝斜碇锌瞻祝?br />
請選擇一組合適的數據填寫在第②組實驗中的a,b處序號 加入的稀硫酸濃度 反應時間/min 收集的氣體/mL 反應速率/mL?min-1 ① 1mol/L 11 10 ② 2mol/L a 10 b ③ 4mol/L
10 5.0
A.12和0.83 B.6和1.67
C.1和10 D.6和3.67
(3)如果將錐形瓶用熱水浴加熱,則收集10mL氫氣的時間將.發(fā)布:2024/6/27 10:35:59組卷:33引用:1難度:0.9 -
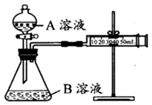 2.酸性KMnO4溶液與H2C2O4溶液的反應通常用來研究濃度對反應速率的影響。
2.酸性KMnO4溶液與H2C2O4溶液的反應通常用來研究濃度對反應速率的影響。
現有甲、乙兩個實驗小組設計不同的實驗方案如下:
甲組:改變反應物的濃度,通過溶液褪色的時間來比較反應速率快慢。
可以使用的試劑有:①0.2mol/L H2C2O4溶液、②0.4mol/L H2C2O4溶液、
③0.02mol/L H2C2O4溶液、④0.1mol/L KMnO4酸性溶液、⑤0.01mol/L KMnO4酸性溶液
(1)酸性KMnO4溶液與H2C2O4溶液反應的化學反應方程式為:;
(2)若假設:所用草酸溶液與高錳酸鉀溶液體積比為1:2,請從上面的五種溶液中選擇本
實驗所需的三種溶液(填寫序號);
(3)問題討論:已知該實驗過程中溶液溫度幾乎不變,但是依據實驗數據發(fā)現開始一段時
間后速率卻在增大。
①你認為引起該反應速率增大的因素是。
②欲設計實驗確認,設計實驗如表:
試驗中還需要補充的試劑為:實驗
編號X mol/LKMnO4酸性溶液/mL Y mol/LH2C2O4溶液/mL MnSO4溶液
/mL褪色時間/s 1 4mL 2mL a 2 b c 0mL ,體積為:mL
乙組:通過測定不同濃度的溶液生成CO2氣體體積的方法來比較化學反應速率的大小。實驗裝置如圖,實驗時分液漏斗中A溶液一次性放入B溶液中已知乙組完成兩次實驗分別是Ⅰ、Ⅱ.請完成以下各空:
(4)如何檢查該裝置的氣密性:。
(5)分析所給實驗儀器,實現該實驗目的還欠缺的用品:。發(fā)布:2024/6/27 10:35:59組卷:36引用:2難度:0.5 -
3.如表是研究性學習小組研究影響過氧化氫(H2O2)分解速率的因素時采集的一組數據:用10mL H2O2溶液制取150mL氧氣所需的時間(單位:s)
請回答下列問題:
濃 度
反應條件30% H2O2 15% H2O2 10% H2O2 5% H2O2 無催化劑、不加熱 幾乎不反應 幾乎不反應 幾乎不反應 幾乎不反應 無催化劑、加 熱 360 480 540 720 MnO2催化劑、加熱 10 25 60 120
(1)該研究小組在設計方案時,考慮了濃度、、等反應條件對過氧化氫分解速率的影響.
(2)從上述影響過氧化氫分解速率的三個因素說明這些因素對分解速率有何影響?;;.發(fā)布:2024/6/27 10:35:59組卷:38引用:6難度:0.5


