甲烷是一種重要的化工原料和清潔能源,研究其相關反應并合理利用具有重要意義.請回答下列問題:
(1)已知:
a.工業上甲烷可用于制造合成氣,常溫常壓下其反應為CH4(g)+H2O(l)?CO(g)+3H2(g)△H=+250.1kJ?mol-1;
b.CO(g)、H2(g)的燃燒熱依次為283.0kJ?mol-1、285.8kJ?mol-1。常溫常壓下,16g甲烷完全燃燒生成液態水放出的熱量為 890.3890.3kJ。
(2)將1mol CH4(g)和3mol H2O(g)充入盛有催化劑的5L剛性密閉容器中發生反應:CH4(g)+H2O(g)?CO(g)+3H2(g)(△H>0),相同時間內測得CO的體積分數[φ(CO)]與溫度(T)的關系如圖1所示。
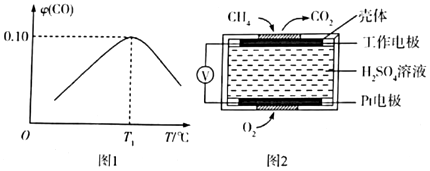
①既能提高甲烷的轉化率又能提高反應速率的措施是 BCBC。(填序號)
A.在其他條件不變時,充入氮氣
B.在其他條件不變時,再充入4mol H2O(g)
C.在其他條件不變時,升高反應溫度
D.在其他條件不變時,再充入1mol CH4(g)和3mol H2O(g)
②溫度大于T1℃時,隨著溫度的升高,CO的體積分數降低的可能原因是 催化劑的活性降低或發生副反應催化劑的活性降低或發生副反應。(寫一條即可)
③假設T1℃時反應達到平衡所需的時間為5min,平衡時φ(CO)=0.10,則從開始至達到平衡時間內用H2表示的化學反應速率為 0.06mol/(L?min)0.06mol/(L?min),反應的平衡常數K為 0.0540.054。
(3)甲烷屬于易燃易爆氣體,可用電化學原理測定空氣中甲烷的含量防止爆炸事故的發生,其原理如圖所示,則負極的電極反應式為 CH4-8e-+2H2O=CO2+8H+CH4-8e-+2H2O=CO2+8H+;若測得標準狀況下空氣中甲烷的含量為0.112L,當甲烷完全被氧化時消耗的H2SO4為 00mol。
【答案】890.3;BC;催化劑的活性降低或發生副反應;0.06mol/(L?min);0.054;CH4-8e-+2H2O=CO2+8H+;0
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:15引用:1難度:0.4
相似題
-
1.已知白磷的結構為空心正四面體(
 ),磷在空氣中燃燒生成P4O10,其中每個磷原子與一個氧原子雙鍵結合,其余的氧插入P-P鍵之間,已知有關形成1mol鍵所放出的能量數據:
),磷在空氣中燃燒生成P4O10,其中每個磷原子與一個氧原子雙鍵結合,其余的氧插入P-P鍵之間,已知有關形成1mol鍵所放出的能量數據:
P+P→P-P,△H=-172kJ?mol-1; O+O→O=O,△H=-498kJ?mol-1
P+O→P-O,△H=-335kJ?mol-1; P+O→P=O,△H=-470kJ?mol-1
則反應P4(s)+5O2(g)=P4O10(s)中的燃燒熱為( )A.2378 kJ?mol-1 B.4868 kJ?mol-1 C.2988 kJ?mol-1 D.135 kJ?mol-1 發布:2024/11/17 8:0:1組卷:8引用:1難度:0.7 -
 2.(1)已知H-H鍵鍵能(化學鍵斷裂時吸收或形成時釋放的能量)為436kJ/mol,N-H鍵鍵能為391kJ/mol,根據熱化學方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,可知N≡N鍵的鍵能是kJ/mol。
2.(1)已知H-H鍵鍵能(化學鍵斷裂時吸收或形成時釋放的能量)為436kJ/mol,N-H鍵鍵能為391kJ/mol,根據熱化學方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,可知N≡N鍵的鍵能是kJ/mol。
(2)碳(s)在氧氣供應不充足時,生成CO同時還部分生成CO2,因此無法通過實驗直接測得反應:C(s)+O2(g)═CO(g)的△H。但可設計實驗、利用蓋斯定律計算出該反應的△H,計算時需要測得的實驗數據有12。
(3)運動會中的火炬一般采用丙烷(C3H8)為燃料。丙烷熱值較高,污染較小,是一種優良的燃料。試回答下列問題:
①如圖是一定量丙烷完全燃燒生成CO2和1mol H2O(l)過程中的能量變化圖,圖中的括號內應填入(“+”或“-”)。
②寫出表示丙烷燃燒熱的熱化學方程式:。
(4)高氯酸、硫酸、硝酸和鹽酸都是強酸,其酸性在水溶液中差別不大。以下是某溫度下這四種酸在冰醋酸中的電離常數:
由以上表格中數據判斷以下說法不正確的是酸 HClO4 H2SO4 HCl HNO3 Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10 。
A.在冰醋酸中這四種酸都沒有完全電離
B.在冰醋酸中高氯酸是這四種酸中酸性最強的酸
C.在冰醋酸中硫酸的電離方程式為:H2SO4═2H++SO42-
D.水對這四種酸的強弱沒有區分能力,但冰醋酸可以區分這四種酸的強弱
(5)常溫下,0.1mol?L-1的CH3COOH溶液加水稀釋過程中,下列表達式的數值變大的是。
A.c(H+)
B.c(H+)c(CH3COOH)
C.c(CH3COO-)
D.c(CH3COOH)發布:2024/11/7 8:0:2組卷:10引用:2難度:0.5 -
3.乙醇汽油的推廣使用,帶動了糧食深加工相關產業的發展,具有較好的經濟效益和社會效益,促進了農業生產與消費的良性循環.
(1)下列說法中正確的是.
①推廣乙醇汽油可以減輕環境污染,可降低尾氣中一氧化碳的含量.
②乙醇汽油作為一種新型清潔燃料,是目前世界上可再生能源的發展重點之一.
③乙醇屬于可再生資源,使用乙醇汽油可以緩解目前石油緊缺的矛盾.
④太陽能、風能、水能、生物能、地熱能、潮汐能等都屬于可再生能源.
A.①②④B.①②③C.③④D.①②③④
(2)通過分析反應過程中化學鍵的斷開和形成,應用有關數據,可以估算化學反應的反應熱.已知有關數據見下表:
工業制乙醇目前主要方法是乙烯水化法化學鍵 C=C C-C C-H C-O O-H
斷開鍵要吸收的能量(單位:kJ?mol-1)
602
345.6
411
357.7
458.8
(CH2=CH2+H2OCH3CH2OH),估算制取1mol 乙醇的反應熱△H=催化劑加熱、加壓kJ?mol-1.
(3)在相同溫度和壓強下,將46g乙醇分別在純氧中和空氣中完全燃燒,在純氧中燃燒熱為△H1,在空氣中燃燒熱為△H2,則△H1△H2(填“>”、“<”、“=”或“無法判斷”).發布:2024/11/7 8:0:2組卷:36引用:2難度:0.5


