海洋是人類寶貴的自然資源,海水“曬鹽”和海水“制堿”體現了人類利用和改造自然的智慧。
(一)請根據粗鹽“制堿”的流程圖(圖1)回答問題:

已知:常溫下,氨氣極易溶于水。
(1)海水“曬鹽”是通過 蒸發結晶蒸發結晶(填“蒸發結晶”或“降溫結晶”)的方法獲取粗鹽。海水“制堿”的產物中可作化肥的是 NH4ClNH4Cl。
(2)步驟“Ⅰ除雜”中,操作步驟依次為:加水溶解→加過量試劑①→加過量試劑②→過濾→加適量鹽酸,以下試劑①②組合選用合理的是 ADAD(填序號)。
A.①Ca(OH)2、②Na2CO3
B.①Na2CO3、②Ca(OH)2
C.①KOH、②Na2CO3
D.①NaOH、②Na2CO3
(3)步驟Ⅲ先向飽和食鹽水中通入氨氣得到飽和氨鹽水,常溫下,飽和氨鹽水的pH >>7(填“>”“=”或“<”)。先通過氨氣,再通入二氧化碳的目的是 有利于吸收更多的二氧化碳有利于吸收更多的二氧化碳。寫出步驟Ⅲ反應的化學方程式:NH3+H2O+CO2+NaCl=NaHCO3↓+NH4ClNH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl。
(4)寫出流程中步驟Ⅳ生成純堿的化學方程式:2NaHCO3 △ Na2CO3+CO2↑+H2O2NaHCO3 △ Na2CO3+CO2↑+H2O。
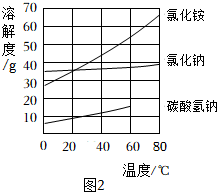
(5)步驟Ⅲ的產物中NaHCO3比NH4Cl先結晶析出。請結合生產原理及圖2解釋其原因:相同溫度下碳酸氫鈉的溶解度比氯化銨小,且反應時生成碳酸氫鈉的質量比氯化銨大相同溫度下碳酸氫鈉的溶解度比氯化銨小,且反應時生成碳酸氫鈉的質量比氯化銨大。
(二)粗鹽“制堿”所得NaHCO3是一種應用廣泛的鹽,化學小組對其進行探究。
(6)NaHCO3能用于醫療上治療胃酸過多癥,反應的化學方程式為 NaHCO3+HCl=NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑。
【提出問題】實驗室中如何制取少量NaHCO3?
【查閱資料】資料一:研究發現,NaHCO3溶于水時吸收熱量,Na2CO3溶于水時放出熱量。
【實驗制備】根據I中制堿原理設計圖3所示裝置制取NaHCO3。反應結束后,將試管中的混合物過濾、洗滌、低溫烘干得白色固體。
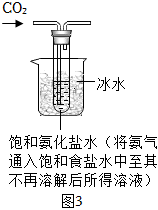
(7)燒杯中冰水的作用是 降低碳酸氫鈉的溶解度以利于其結晶析出降低碳酸氫鈉的溶解度以利于其結晶析出。
(8)能進一步確認該白色固體是NaHCO3的方案是 取少量白色固體于試管中,加適量水溶解,用溫度計測量溶液的溫度,若低于室溫,說明該白色固體是NaHCO3取少量白色固體于試管中,加適量水溶解,用溫度計測量溶液的溫度,若低于室溫,說明該白色固體是NaHCO3(請用物理方法鑒別)。
(9)圖2中NaHCO3的溶解度在60℃后無數據的原因可能是 溫度高于或等于60℃時,NaHCO3受熱分解溫度高于或等于60℃時,NaHCO3受熱分解。
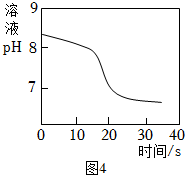
【性質探究】常溫下取一定量NaHCO3溶液于燒杯中,插入pH傳感器,向燒杯中持續滴加CaCl2溶液,有白色沉淀生成,當溶液pH繼續減小時有無色氣體產生。反應過程中溶液pH隨時間變化如圖4所示。
【查閱資料】
資料二:NaHCO3溶于水后,少量的HCO-3能同時發生如下變化:
變化①:HCO-3+H2O→H2CO3+OH-;
變化②:HCO-3→CO2-3+H+。
資料三:溶液酸堿性與單位體積溶液中H+和OH-數目的相對大小有關。常溫下,當單位體積溶液中OH-的數目大于H+的數目時,溶液的pH>7,反之pH<7;單位體積溶液中所含H+數目越大,溶液pH越小。
【交流反思】
(10)NaHCO3溶液顯 堿堿性(填“酸”“堿”或“中”),結合資料二、三從微觀角度說明原因:NaHCO3溶于水后,發生變化①的碳酸氫根離子數目比發生變化②的碳酸氫根離子數目多,導致單位體積溶液中的OH-數目比H+多;NaHCO3溶于水后,發生變化①的碳酸氫根離子數目比發生變化②的碳酸氫根離子數目多,導致單位體積溶液中的OH-數目比H+多;。
(11)根據本實驗,下列說法錯誤的是 cc(填序號)。
a.pH繼續減小時生成的無色氣體為CO2
b.從0~30s,單位體積溶液中H+數目不斷增大
c.加入CaCl2溶液的過程中,資料二中的變化①程度大于變化②
△
△
HCO
-
3
HCO
-
3
HCO
-
3
CO
2
-
3
【答案】蒸發結晶;NH4Cl;AD;>;有利于吸收更多的二氧化碳;NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O;相同溫度下碳酸氫鈉的溶解度比氯化銨小,且反應時生成碳酸氫鈉的質量比氯化銨大;NaHCO3+HCl=NaCl+H2O+CO2↑;降低碳酸氫鈉的溶解度以利于其結晶析出;取少量白色固體于試管中,加適量水溶解,用溫度計測量溶液的溫度,若低于室溫,說明該白色固體是NaHCO3;溫度高于或等于60℃時,NaHCO3受熱分解;堿;NaHCO3溶于水后,發生變化①的碳酸氫根離子數目比發生變化②的碳酸氫根離子數目多,導致單位體積溶液中的OH-數目比H+多;;c
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/8 8:0:9組卷:75引用:2難度:0.3
相似題
-
1.碳酸氫鈉是一種應用廣泛的鹽,化學小組對其進行了探究。
(1)NaHCO3可稱為鈉鹽或碳酸氫鹽,它是由Na+和(填離子符號)構成,醫療上能用于治療胃酸(含有鹽酸)過多癥,反應的化學方程式為。
【提出問題】實驗室中如何制取少量NaHCO3?
【查閱資料】
材料一:侯氏制堿的原理:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3Na2CO3+CO2↑+H2O。△
材料二:研究發現,NaHCO3溶于水時吸收熱量,Na2CO3溶于水時放出熱量。
【實驗制備】根據侯氏制堿原理設計如圖1所示裝置制取NaHCO3。
反應結束后,將試管中的混合物過濾洗滌,低溫烘干得白色固體。
(2)燒杯中冰水的作用是。
(3)能進一步確認該白色固體是NaHCO3的實驗方案是(須用到的儀器和藥品:試管、溫度計、水)。
(4)如圖2中碳酸氫鈉的溶解度在60℃后無數據的原因可能是。
【性質探究】
常溫下,取一定量的NaHCO3溶液于燒杯中,插入pH傳感器,向燒杯中持續滴加CaCl2溶液,有白色沉淀生成,當溶液的pH變為6.68時開始有無色氣體產生。反應過程中溶液的pH隨時間變化如圖3所示。
【查閱資料】
材料三NaHCO3溶于水后,少量的能同時發生如下變化:HCO-3
變化①:+H2O→H2CO3+OH-;HCO-3
變化②:→HCO-3+H+。CO2-3
材料四:溶液的酸堿性與溶液中H+和OH-數目的相對大小有關。常溫下,當單位體積溶液中OH-的數目大于H+的數目時溶液的pH>7,反之pH<7;單位體積溶液中所含的H+數目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液顯(填“酸”“堿”或“中”)性,結合材料三、四從微觀角度說明原因:。
(6)根據本實驗,下列說法錯誤的是(填字母)。
a.pH<6.68時生成的無色氣體為CO2
b.從0~30s,單位體積溶液中H+數目不斷增大
c.不能用CaCl2溶液鑒別Na2CO3和NaHCO3溶液發布:2024/12/25 15:30:1組卷:591引用:4難度:0.5 -
2.關于鹽的性質研究是一項重要的課題,某興趣小組以“探究碳酸氫鈉的性質”為主題開展項目式學習。
【任務一】認識碳酸氫鈉
(1)下列關于碳酸氫鈉的說法正確的是。
A.碳酸氫鈉是由Na+和構成HCO-3
B.碳酸氫鈉俗稱純堿
C.碳酸氫鈉醫療上能用于治療胃酸過多癥
D.碳酸氫鈉難溶于水
【任務二】探究碳酸氫鈉的性質
(2)探究碳酸氫鈉與稀鹽酸反應:興趣小組取適量碳酸氫鈉粉末于甲試管中,加入稀鹽酸,如圖1所示,觀察到甲試管中有氣泡產生,乙中,說明碳酸氫鈉能與稀鹽酸反應生成CO2,寫出試管甲中反應的化學方程式。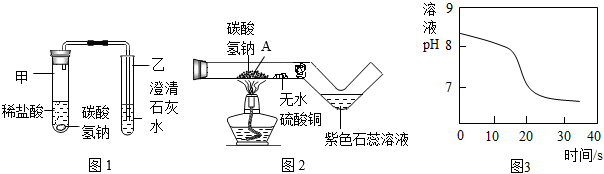
(3)探究碳酸氫鈉的熱穩定性:用酒精燈充分加熱玻璃管,如圖2所示。
資料:無水硫酸銅呈白色,遇水后呈藍色
①發現玻璃管內無水硫酸銅變藍,紫色石蕊溶液變紅,說明碳酸氫鈉受熱易分解,且有和二氧化碳生成。
②實驗后興趣小組同學猜想玻璃管A處固體產物僅是Na2CO3而不含有NaOH,請設計實驗證明(寫出具體步驟和現象):。
(4)常溫下,興趣小組同學取一定量的NaHCO3溶液于燒杯中,插入pH傳感器,向燒杯中持續滴加CaCl2溶液,有白色沉淀生成,當溶液的pH變為6.68時開始有無色氣體產生。反應過程中溶液的pH隨時間變化如圖3所示。
【查閱資料】
材料一:NaHCO3溶于水后,少量的能同時發生如下變化:HCO-3
變化①:+H2O→H2CO3+OH-HCO-3
變化②:→HCO-3+H+CO2-3
材料二:溶液的酸堿性與溶液中H+和OH-數目的相對大小有關。常溫下,當單位體積溶液中OH-的數目大于H+的數目時溶液的pH>7,反之pH<7;單位體積溶液中所含的H+數目越大,溶液的pH越小。
①根據上述實驗可知NaHCO3溶液顯堿性,結合材料一、二從微觀角度說明原因:。
②根據本實驗,可知從0~30s,單位體積溶液中H+數目不斷(填“增大”或“減小”)。發布:2024/12/25 17:0:2組卷:94引用:2難度:0.4 -
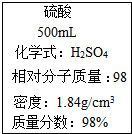 3.圖是一瓶濃硫酸標簽上的部分內容,某探究小組的同學對這瓶硫酸進行了如下探究,請你參與.
3.圖是一瓶濃硫酸標簽上的部分內容,某探究小組的同學對這瓶硫酸進行了如下探究,請你參與.
[查閱資料]濃硫酸有強腐蝕性,溶于水會放熱;硫酸鋇不溶于水也不溶于酸.
[探究一]濃硫酸稀釋時會放熱.
(1)稀釋濃硫酸時,所需儀器主要有,應如何稀釋濃硫酸?.測量稀釋前后溶液的溫度,有明顯升高的現象.結論:濃硫酸溶于水放熱.
[探究二]稀硫酸與氫氧化鈉溶液能發生反應.圖10
(2)稀硫酸與氫氧化鈉溶液反應的化學方程式為實驗步驟 實驗現象 實驗結論 先用pH試紙測定稀硫酸的pH,再逐滴加入氫氧化鈉溶液并不斷振蕩,同時測混合液的pH pH逐漸變大,
最后pH≥7稀硫酸與氫氧化鈉
溶液能發生反應.
(3)實驗中僅從溶液pH變大,而不強調pH≥7,不能得出稀硫酸與氫氧化鈉溶液一定發生反應的結論,理由是.
[探究三]由于該試劑瓶瓶口密封簽已破損,同學們懷疑該濃硫酸的質量分數與標簽不相符.
[提出問題]該濃硫酸的質量分數是否發生變化?
[實驗探究](4)取該濃硫酸和足量BaCl2溶液反應,過濾、洗滌、干燥沉淀.實驗中如何確定硫酸已完全反應.
(5)為達到實驗目的,實驗中必須要測知的數據是.
[探究結論](6)由實驗測得的數據計算出的硫酸的質量分數與標簽不符.該硫酸的質量分數應98%(填“大于”或“小于”).發布:2025/1/6 8:0:1組卷:38引用:1難度:0.5


