2022年福建省廈門大學附屬科技中學創新班中考化學模擬試卷
發布:2024/6/20 8:0:9
一、選擇題(每小題只有1個正確選項,每題5分,共25分)
-
1.化學與生活、生產密切相關,下列說法正確的是( )
A.《物理小識》記載“青礬(綠礬FeSO4?7H2O)廠氣熏人,衣服當之易爛,裁木不茂。”其中“青礬廠氣”是CO和CO2 B.《內經》記載“五谷為養、五果為助、五禽為益、五菜為充”,文中涉及糖類、維生素、蛋白質等人體需營養素 C.《夢溪筆談》中對寶劍的記載:“古人以劑鋼為刃,柔鐵為莖干,不爾則多斷折。”說明鐵的合金硬度比純鐵的大,熔點比純鐵的高 D.“春蠶到死絲方盡,蠟炬成灰淚始干”中的“絲”灼燒后有燒紙的氣味 組卷:63引用:2難度:0.6 -
2.60℃時,向100g水中加入一定量KNO3形成溶液,再降溫至20℃,析出固體質量的變化如圖1。結合圖2,下列說法正確的是( )
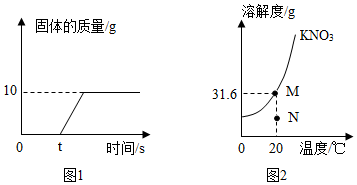
A.加入的KNO3質量為41.6g B.降溫過程中KNO3溶液始終為飽和溶液 C.蒸發溶劑可將M點的溶液轉化到N點 D.20℃時,100g KNO3飽和溶液中有KNO331.6g 組卷:1377引用:37難度:0.7 -
3.室溫下足量鎂片、鋁片(已去除氧化膜)分別與40g溶質質量分數為7.3%的稀鹽酸反應(裝置如圖甲),用壓強傳感器測得裝置內壓強隨時間的變化關系如圖乙。已知:相同溫度下,裝置內壓強與產生氣體的體積成正比。下列說法錯誤的是( )

A.曲線①為鎂與鹽酸反應的壓強變化曲線 B.AB段下降的原因是隨反應的進行鹽酸濃度逐漸減小 C.反應結束時消耗鎂片與鋁片的質量比為4:3 D.反應結束后二者產生氫氣的質量相等 組卷:28引用:2難度:0.5
二、非選擇題(4題,共75分)
-
8.隨著手機、電腦的廣泛使用,現代社會的電子垃圾越來越多。為了節約資源,可從廢線路板中提煉貴重金屬和制備硫酸銅晶體,其中一種工藝流程如圖:
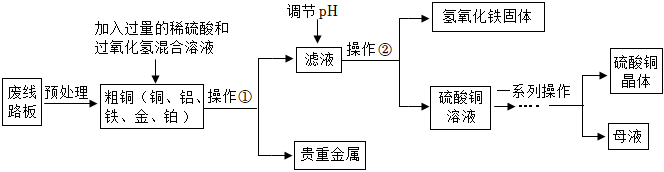
【查閱資料】
①在酸性環境中有過氧化氫存在時,鐵和銅分別會轉化為鐵離子和銅離子。
②一定條件下,銅離子、鐵離子沉淀的pH見下表:
(1)從垃圾分類的角度分析,廢線路板屬于Cu2+ Fe3+ 開始沉淀 4.7 1.9 完全沉淀 6.7 3.2 (填序號)。
A.廚余垃圾
B.可回收垃圾
C.有害垃圾
D.其他垃圾
(2)實驗室中進行操作①中用到的玻璃儀器有。
(3)寫出粗銅中的銅發生反應的化學方程式。
(4)流程中“調節pH”的目的是除去濾液中的(填離子符號),為了保證得到純凈的硫酸銅晶體,pH應調整為(填范圍)。調節pH適宜選用的試劑為(填序號)
A.MgO
B.CuO
C.NaOH
D.Cu(OH)2
(5)最終得到的硫酸銅晶體可能會含有硫酸雜質,以下最適宜的洗滌液為(填序號)。
A.蒸餾水
B.飽和硫酸銅溶液
C.飽和氫氧化鈉溶液
D.飽和氯化鋇溶液
流程中“一系列操作”指、、、洗滌、干燥。
(6)將25.0g膽礬放在坩堝內加熱,固體質量與成分隨溫度變化的曲線如圖所示。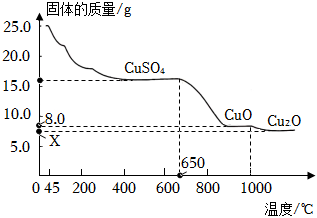
①加熱至℃時,CuSO4開始分解。
②加熱至1000℃時,CuO開始分解,生成Cu2O與一種氣體,該反應化學方程式為。如圖所示,x的理論值為g。組卷:47引用:2難度:0.5 -
9.海洋是人類寶貴的自然資源,海水“曬鹽”和海水“制堿”體現了人類利用和改造自然的智慧。
(一)請根據粗鹽“制堿”的流程圖(圖1)回答問題:
已知:常溫下,氨氣極易溶于水。
(1)海水“曬鹽”是通過(填“蒸發結晶”或“降溫結晶”)的方法獲取粗鹽。海水“制堿”的產物中可作化肥的是。
(2)步驟“Ⅰ除雜”中,操作步驟依次為:加水溶解→加過量試劑①→加過量試劑②→過濾→加適量鹽酸,以下試劑①②組合選用合理的是(填序號)。
A.①Ca(OH)2、②Na2CO3
B.①Na2CO3、②Ca(OH)2
C.①KOH、②Na2CO3
D.①NaOH、②Na2CO3
(3)步驟Ⅲ先向飽和食鹽水中通入氨氣得到飽和氨鹽水,常溫下,飽和氨鹽水的pH7(填“>”“=”或“<”)。先通過氨氣,再通入二氧化碳的目的是。寫出步驟Ⅲ反應的化學方程式:。
(4)寫出流程中步驟Ⅳ生成純堿的化學方程式:。
(5)步驟Ⅲ的產物中NaHCO3比NH4Cl先結晶析出。請結合生產原理及圖2解釋其原因:。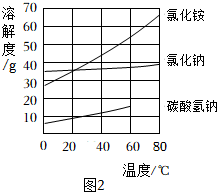
(二)粗鹽“制堿”所得NaHCO3是一種應用廣泛的鹽,化學小組對其進行探究。
(6)NaHCO3能用于醫療上治療胃酸過多癥,反應的化學方程式為。
【提出問題】實驗室中如何制取少量NaHCO3?
【查閱資料】資料一:研究發現,NaHCO3溶于水時吸收熱量,Na2CO3溶于水時放出熱量。
【實驗制備】根據I中制堿原理設計圖3所示裝置制取NaHCO3。反應結束后,將試管中的混合物過濾、洗滌、低溫烘干得白色固體。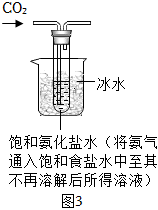
(7)燒杯中冰水的作用是。
(8)能進一步確認該白色固體是NaHCO3的方案是(請用物理方法鑒別)。
(9)圖2中NaHCO3的溶解度在60℃后無數據的原因可能是。
【性質探究】常溫下取一定量NaHCO3溶液于燒杯中,插入pH傳感器,向燒杯中持續滴加CaCl2溶液,有白色沉淀生成,當溶液pH繼續減小時有無色氣體產生。反應過程中溶液pH隨時間變化如圖4所示。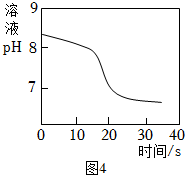
【查閱資料】
資料二:NaHCO3溶于水后,少量的能同時發生如下變化:HCO-3
變化①:+H2O→H2CO3+OH-;HCO-3
變化②:→HCO-3+H+。CO2-3
資料三:溶液酸堿性與單位體積溶液中H+和OH-數目的相對大小有關。常溫下,當單位體積溶液中OH-的數目大于H+的數目時,溶液的pH>7,反之pH<7;單位體積溶液中所含H+數目越大,溶液pH越小。
【交流反思】
(10)NaHCO3溶液顯性(填“酸”“堿”或“中”),結合資料二、三從微觀角度說明原因:。
(11)根據本實驗,下列說法錯誤的是(填序號)。
a.pH繼續減小時生成的無色氣體為CO2
b.從0~30s,單位體積溶液中H+數目不斷增大
c.加入CaCl2溶液的過程中,資料二中的變化①程度大于變化②組卷:75引用:2難度:0.3


