實驗小組探究鋁片做電極材料時的原電池反應(yīng),設(shè)計下表中裝置進(jìn)行實驗并記錄。
【實驗1】
| 裝置 | 實驗現(xiàn)象 |
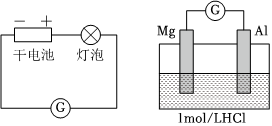 |
左側(cè)裝置電流計指針向右偏轉(zhuǎn),燈泡亮 右側(cè)裝置電流計指針向右偏轉(zhuǎn),鎂條、鋁條表面產(chǎn)生無色氣泡 |
負(fù)
負(fù)
極。【實驗2】將實驗1中的電解質(zhì)溶液換為NaOH溶液進(jìn)行實驗2。
(2)該小組同學(xué)認(rèn)為,此時原電池的總反應(yīng)為2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,據(jù)此推測應(yīng)該出現(xiàn)的實驗現(xiàn)象為
計指針偏轉(zhuǎn),Al電極將不斷減少,Mg電極上產(chǎn)生大量的氣泡
計指針偏轉(zhuǎn),Al電極將不斷減少,Mg電極上產(chǎn)生大量的氣泡
。實驗2實際獲得的現(xiàn)象如下:
| 裝置 | 實驗現(xiàn)象 |
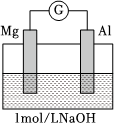 |
ⅰ.電流計指針迅速向右偏轉(zhuǎn),鎂條表面無氣泡,鋁條表面有氣泡 ⅱ.電流計指針逐漸向零刻度恢復(fù),經(jīng)零刻度后繼續(xù)向左偏轉(zhuǎn)。鎂條表面開始時無明顯現(xiàn)象,一段時間后有少量氣泡逸出,鋁條表面持續(xù)有氣泡逸出 |
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
。(4)ⅱ中“電流計指針逐漸向零刻度恢復(fù)”的原因是
Mg放電后生成Mg(OH)2,附著在鎂條表面,使Mg的放電反應(yīng)難以發(fā)生,導(dǎo)致指針歸零
Mg放電后生成Mg(OH)2,附著在鎂條表面,使Mg的放電反應(yīng)難以發(fā)生,導(dǎo)致指針歸零
。【實驗3和實驗4】
為了排除Mg條的干擾,同學(xué)們重新設(shè)計裝置并進(jìn)行實驗3和實驗4,獲得的實驗現(xiàn)象如下:
| 編號 | 裝置 | 實驗現(xiàn)象 |
| 實驗3 | 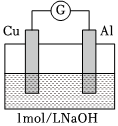 |
電流計指針向左偏轉(zhuǎn)。鋁條表面有氣泡逸出,銅片沒有明顯現(xiàn)象;約10分鐘后,銅片表面有少量氣泡產(chǎn)生,鋁條表面氣泡略有減少。 |
| 實驗4 | 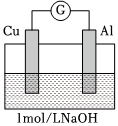 煮沸冷卻后的溶液 |
電流計指針向左偏轉(zhuǎn)。鋁條表面有氣泡逸出,銅片沒有明顯現(xiàn)象:約3分鐘后,銅片表面有少量氣泡產(chǎn)生,鋁條表面氣泡略有減少。 |
ABC
ABC
(填字母序號)。A.上述兩裝置中,開始時銅片表面得電子的物質(zhì)是O2
B.銅片表面開始產(chǎn)生氣泡的時間長短與溶液中溶解氧的多少有關(guān)
C.銅片表面產(chǎn)生的氣泡為H2
D.由“鋁條表面氣泡略有減少”能推測H+在銅片表面得電子
(6)由實驗1~實驗4可推知,鋁片做電極材料時的原電池反應(yīng)與
另一個電極的電極材料、溶液的酸堿性、溶液中溶解的O2
另一個電極的電極材料、溶液的酸堿性、溶液中溶解的O2
等因素有關(guān)。【考點】探究原電池及其工作原理;原電池原理.
【答案】負(fù);計指針偏轉(zhuǎn),Al電極將不斷減少,Mg電極上產(chǎn)生大量的氣泡;O2+2H2O+4e-=4OH-;Mg放電后生成Mg(OH)2,附著在鎂條表面,使Mg的放電反應(yīng)難以發(fā)生,導(dǎo)致指針歸零;ABC;另一個電極的電極材料、溶液的酸堿性、溶液中溶解的O2
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/9/20 0:0:11組卷:119引用:4難度:0.5
相似題
-
1.某化學(xué)興趣小組為了探索Al電極在原電池中的作用,設(shè)計并進(jìn)行了以下一系列實驗,實驗結(jié)果記錄如表。
根據(jù)如表中的實驗現(xiàn)象完成下列問題:編號 電極材料 電解質(zhì)溶液 電流計指針偏轉(zhuǎn)方向 ① Mg Al 稀鹽酸 偏向Al ② Al Cu 稀鹽酸 偏向Cu ③ Mg Al NaOH溶液 偏向Mg
(1)實驗1、2的Al所作的電極是否相同?,由此說明在原電池中金屬鋁作正極還是負(fù)極與有關(guān)。
(2)寫出實驗2中的電極反應(yīng)式和電池總反應(yīng)方程式。
(3)實驗3中的鋁作正極還是負(fù)極?鋁電極 銅電極 電池總反應(yīng) ,為什么?。
(4)實驗3的結(jié)果引起了興趣小組的重視,他們以Al、Zn為電極材料,濃硝酸為電解質(zhì)溶液組成了一套裝置,請結(jié)合實驗3的結(jié)果推斷電流計指針的偏轉(zhuǎn)方向應(yīng)為,原因是。
(5)根據(jù)實驗結(jié)果總結(jié):在原電池中金屬鋁作正極還是負(fù)極受到哪些因素的影響?。發(fā)布:2024/6/27 10:35:59組卷:21引用:1難度:0.5 -
2.總電能在生產(chǎn)、生活中起著十分重要的作用。某學(xué)習(xí)小組的同學(xué)利用已經(jīng)學(xué)習(xí)的氧化還原反應(yīng)知識與電流的產(chǎn)生進(jìn)行探究。
(1)【引發(fā)思考】氧化還原反應(yīng)的發(fā)生的本質(zhì)是。
(2)【提出問題】可否讓氧化還原反應(yīng)中某些帶電粒子的移動產(chǎn)生電流?
【查閱資料】
①導(dǎo)線中的電流是由于電子的定向移動產(chǎn)生的。
②2019版人教版化學(xué)教材必修二P36有下描述:利用反應(yīng)Zn+H2SO4=ZnSO4+H2↑(用單線橋分析此反應(yīng)并標(biāo)出電子轉(zhuǎn)移方向和數(shù)目:)。通過如圖1特定裝置使氧化反應(yīng)與還原反應(yīng)分別在兩個不同的區(qū)域進(jìn)行,可以使電子通過導(dǎo)體發(fā)生定向移動,形成電流。
(3)如圖1所示,插入稀硫酸的鋅片和銅片用導(dǎo)線連接時,由于鋅比銅活潑,與稀硫酸作用容易失去電子,被氧化成鋅離子而進(jìn)入溶液;鋅片區(qū)域:(氧化反應(yīng))Zn-2e-=Zn2+;電子由鋅片通過導(dǎo)線流向銅片,溶液中的氫離子從銅片獲得電子,被還原成氫原子,氫原子結(jié)合成氫分子從銅片上放出:銅片區(qū)域:(還原反應(yīng))。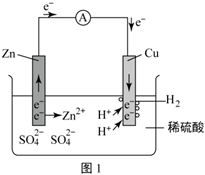
(4)【實驗探究】利用鐵和硫酸銅溶液的反應(yīng)(Fe+CuSO4=FeSO4+Cu)產(chǎn)生電流。
第一步:按圖2裝置組成實驗裝置,用導(dǎo)線將銅片與電流表紅色接線柱相連接,用導(dǎo)線將片與電流表黑色接線柱相連接;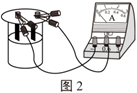
第二步:向燒杯中加入硫酸銅溶液;
第三步:觀察到電流表指針偏轉(zhuǎn),片逐漸溶解,溶液由藍(lán)色逐漸變?yōu)?色。
(5)【交流反思】兩個金屬片區(qū)域發(fā)生的反應(yīng)式分別為①(氧化反應(yīng)):,②(還原反應(yīng)):。發(fā)布:2024/6/27 10:35:59組卷:28引用:1難度:0.7 -
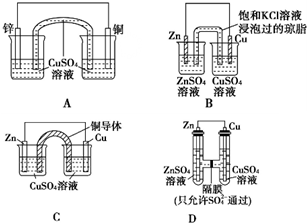 3.某化學(xué)興趣小組對原電池中鹽橋的作用進(jìn)行探究,并設(shè)計了以下實驗裝置:
3.某化學(xué)興趣小組對原電池中鹽橋的作用進(jìn)行探究,并設(shè)計了以下實驗裝置:
(1)以上四個裝置中,能發(fā)揮鹽橋作用的是
(2)若以A、B為電源,分別電解等濃度、等體積的NaCl溶液,當(dāng)消耗等質(zhì)量Zn時,產(chǎn)生的H2(填“A”或“B”)多,原因是
(3)如果C裝置中U形銅導(dǎo)體在插入溶液前是粗細(xì)均勻的,插入足夠長時間后,仔細(xì)比較兩端的變化是.
(4)D裝置充分作用后,左側(cè)溶液中的濃度SO2-4(填“=”“>”或“<”)右側(cè)的濃度.SO2-4發(fā)布:2024/12/11 8:0:1組卷:25引用:0難度:0.9


