2023-2024學年北京市清華附中高二(上)統練化學試卷(10月份)(二)
發布:2024/9/20 0:0:11
本部分共25題,每題3分;共75分.每題均有一個選項最符合題目要求
-
1.為防止輪船船體的腐蝕,應在船殼下水線位置嵌入一定數量的( )
A.銅片 B.鋅片 C.碳棒 D.銀片 組卷:11引用:7難度:0.9 -
2.N2(g)+3H2(g)?2NH3(g)ΔH<0。反應達平衡時,下列措施能提高N2轉化率的是( )
①降溫②恒壓通入惰性氣體③增加N2的濃度④加壓⑤催化劑A.①④ B.①② C.②⑤ D.③④ 組卷:32引用:5難度:0.5 -
3.下列關于化學反應速率的說法正確的是( )
①恒溫時,增大壓強,化學反應速率一定加快
②其他條件不變,溫度越高,化學反應速率越快
③使用催化劑可改變反應速率,從而改變該反應過程中吸收或放出的熱量
④3mol?L-1?s-1的反應速率一定比1mol?L-1?s-1的反應速率大
⑤有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加單位體積內活化分子數,從而使反應速率增大
⑥增大反應物濃度,可增大活化分子的百分數,從而使單位時間有效碰撞次數增多A.②⑥ B.②⑤ C.①②③⑤ D.①②④⑤ 組卷:229引用:17難度:0.9 -
4.下列做法的目的與改變化學反應速率無關的是( )
A.在糕點包裝內放置小包除氧劑 B.在糖果制作過程中添加著色劑 C.高爐煉鐵前先將鐵礦石粉碎 D.牛奶在冰箱里保存 組卷:36引用:5難度:0.5 -
5.25℃和1.01×105Pa時,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)ΔH=+49kJ?mol-1,該反應能自發進行的原因是( )
A.是吸熱反應 B.是放熱反應 C.是熵減少的反應 D.熵增大效應大于焓效應 組卷:17引用:2難度:0.7 -
6.一定條件下,在2L密閉容器中發生反應:2A(s)+3B(g)═2C(g)+4D(g),測得5min內,A的物質的量減小了10mol,則0~5min內該反應的平均速率為( )
A.v(A)=1.0mol/(L?min) B.v(B)=1.5mol/(L?min) C.v(C)=2.0mol/(L?min) D.v(D)=0.5mol/(L?min) 組卷:359引用:4難度:0.8 -
7.科學家用X射線激光技術觀察到CO與O在催化劑表面形成化學鍵的過程。
反應過程的示意圖如圖。下列說法不正確的是( )
A.CO2含有極性共價鍵 B.上述過程表示CO和O生成CO2 C.上述過程中CO斷鍵形成C和O D.從狀態Ⅰ到狀態Ⅲ,有能量放出 組卷:102引用:9難度:0.6 -
8.《天工開物》種記載:“凡鐵分生、熟,出爐未炒則生,既炒則熟。生熟相和,煉成則鋼”。我國古代煉鐵的流程如圖所示。

下列敘述正確的是( )A.在相同的潮濕空氣中,“生鐵”耐腐蝕性比“熟鐵“強 B.碳素鋼既能發生吸氧腐蝕,又能發生析氫腐蝕 C.煉鐵需要的熱量由C和CO2反應提供 D.我國古代煉鐵的過程中不會產生對環境有害的氣體 組卷:44引用:2難度:0.7 -
9.如圖所示實驗操作正確的是( )

A.甲可用于干海帶的灼燒 B.乙用于乙醇苯溶液的分離 C.丙可用于演示噴泉實驗 D.丁用于驗證犧牲陽極法保護鐵 組卷:25引用:3難度:0.7
第二部分(2道題,共25分)
-
26.氫能是一種極具發展潛力的清潔能源。以下反應是目前大規模制取氫氣的重要方法之一。
CO(g)+H2O(g)?CO2(g)+H2(g)ΔH═-41.2kJ/mol
(1)欲提高CO的平衡轉化率,理論上可以采取的措施為。
A.增大壓強
B.升高溫度
C.加入催化劑
D.通入過量水蒸氣
(2)800C時,該反應的平衡常數K═1.1,在容積為1L的密閉容器中進行反應,測得某一時刻混合物中CO、H2O、CO2、H2的物質的量分別為1mol、3mol、1mol、1mol。
①寫出該反應的平衡常數表達式K═。
②該時刻反應。(填“正向進行”或“逆向進行”或“達平衡”)
(3)830℃時,該反應的平衡常數K═1,在容積為1L的密閉容器中,將2mol CO與2mol H2O混合加熱到830℃。反應達平衡時CO的轉化率為。
(4)圖1表示不同溫度條件下,CO平衡轉化率隨著的變化趨勢。判斷T1、T2和T3的大小關系:n(H2O)n(CO)。說明理由。
(5)實驗發現,其它條件不變,在相同時間內,向反應體系中投入一定量的CaO可以增大H2的體積分數,實驗結果如圖2所示。(已知:1微米=10-6米,1納米=10-9米)。投入納米CaO比微米CaO,H2的體積分數更高的原因是。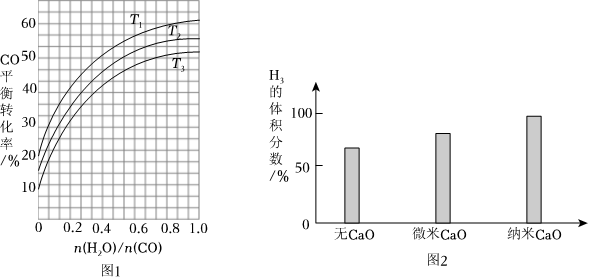 組卷:28引用:4難度:0.3
組卷:28引用:4難度:0.3 -
27.實驗小組探究鋁片做電極材料時的原電池反應,設計下表中裝置進行實驗并記錄。
【實驗1】
(1)實驗1中,電解質溶液為鹽酸,鎂條做原電池的裝置 實驗現象 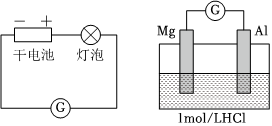
左側裝置電流計指針向右偏轉,燈泡亮
右側裝置電流計指針向右偏轉,鎂條、鋁條表面產生無色氣泡極。
【實驗2】將實驗1中的電解質溶液換為NaOH溶液進行實驗2。
(2)該小組同學認為,此時原電池的總反應為2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,據此推測應該出現的實驗現象為。
實驗2實際獲得的現象如下:
(3)ⅰ中鋁條表面放電的物質是溶解在溶液中的O2,則該電極反應式為裝置 實驗現象 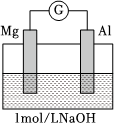
ⅰ.電流計指針迅速向右偏轉,鎂條表面無氣泡,鋁條表面有氣泡
ⅱ.電流計指針逐漸向零刻度恢復,經零刻度后繼續向左偏轉。鎂條表面開始時無明顯現象,一段時間后有少量氣泡逸出,鋁條表面持續有氣泡逸出。
(4)ⅱ中“電流計指針逐漸向零刻度恢復”的原因是。
【實驗3和實驗4】
為了排除Mg條的干擾,同學們重新設計裝置并進行實驗3和實驗4,獲得的實驗現象如下:
(5)根據實驗3和實驗4可獲得的正確推論是編號 裝置 實驗現象 實驗3 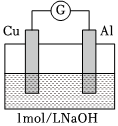
電流計指針向左偏轉。鋁條表面有氣泡逸出,銅片沒有明顯現象;約10分鐘后,銅片表面有少量氣泡產生,鋁條表面氣泡略有減少。 實驗4 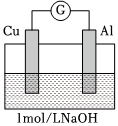
煮沸冷卻后的溶液電流計指針向左偏轉。鋁條表面有氣泡逸出,銅片沒有明顯現象:約3分鐘后,銅片表面有少量氣泡產生,鋁條表面氣泡略有減少。 (填字母序號)。
A.上述兩裝置中,開始時銅片表面得電子的物質是O2
B.銅片表面開始產生氣泡的時間長短與溶液中溶解氧的多少有關
C.銅片表面產生的氣泡為H2
D.由“鋁條表面氣泡略有減少”能推測H+在銅片表面得電子
(6)由實驗1~實驗4可推知,鋁片做電極材料時的原電池反應與等因素有關。組卷:120引用:4難度:0.5


