工業(yè)廢水中常含有一定量的Cr2O72-和CrO42-,它們會(huì)對(duì)人類(lèi)及生態(tài)系統(tǒng)產(chǎn)生很大的傷害,必須進(jìn)行處理。常用的處理方法有兩種。
方法1:還原沉淀法。該法的工藝流程為:CrO2-4H+①轉(zhuǎn)化Cr2O2-7Fe2+②還原Cr3+OH-③沉淀Cr(OH)3↓
(1)流程第①步存在平衡:2CrO42-+2H+?Cr2O72-+H2O,能說(shuō)明第①步反應(yīng)達(dá)平衡狀態(tài)的是CC。(填序號(hào))
A.Cr2O72-和CrO42-的濃度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的顏色不變
(2)流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)。常溫下Cr(OH)3的溶度積Ksp=10-32,當(dāng)c(Cr3+)降至10-5mol/L時(shí)溶液的pH為55。
方法2:電解法
該法用Fe做電極電解含Cr2O72-的酸性廢水,隨著電解進(jìn)行,在陰極附近溶液pH升高,產(chǎn)生Cr(OH)3沉淀。請(qǐng)用電極反應(yīng)方程式解釋下列原因:
(3)用Fe做電極的原因是Fe-2e-=Fe2+Fe-2e-=Fe2+,在陰極附近溶液pH升高的原因是2H++2e-=H2↑2H++2e-=H2↑。
2
-
4
H
+
①
轉(zhuǎn)化
2
-
7
F
e
2
+
②
還原
OH
-
③
沉淀
【答案】C;5;Fe-2e-=Fe2+;2H++2e-=H2↑
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:88引用:2難度:0.6
相似題
-
1.下列說(shuō)法正確的是( )
A.電解精煉銅時(shí),若轉(zhuǎn)移2NA個(gè)電子,則陽(yáng)極減少的質(zhì)量為64g B.合成氨生產(chǎn)中將NH3液化分離,可加快正反應(yīng)速率,提高H2的轉(zhuǎn)化率 C.2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)在常溫下能自發(fā)進(jìn)行,則該反應(yīng)的ΔH>0 D.常溫下,KSP[Al(OH)3]=1×10-33.欲使溶液中c(Al3+)≤1×10-6mol?L-1,需調(diào)節(jié)溶液的pH≥5 發(fā)布:2024/4/20 14:35:0組卷:92引用:2難度:0.6 -
2.氧族元素及其化合物在生產(chǎn)、生活中發(fā)揮著重要的作用。回答下列問(wèn)題:
(1)工業(yè)上常用硫化物(FeS等)作沉淀劑除去廢水中的Cu2+等重金屬離子。已知常溫下CuS飽和溶液中,-lgc(Cu2+)和-lgc(S2-)關(guān)系如圖1所示,Ksp(CuS)=;圖中a、b、c三點(diǎn)對(duì)應(yīng)的溶液中,一定存在CuS沉淀的是(填序號(hào))。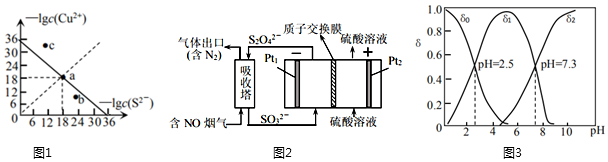
(2)工業(yè)上常用連二亞硫酸鈉(Na2S2O4)消除煙氣中的NO,通過(guò)電解可使Na2S2O4再生,裝置如圖2所示。吸收塔內(nèi)發(fā)生的離子反應(yīng)方程式為。吸收塔內(nèi)每吸收11.2L的NO,理論上Pt2電極上會(huì)放出L氣體(氣體體積均為標(biāo)準(zhǔn)狀況)。
(3)硒是人體必需的微量元素。工業(yè)上將含硒工業(yè)廢料處理得到亞硒酸(H2SeO3)和硒酸(H2SeO4),進(jìn)而制備單質(zhì)硒。亞硒酸(H2SeO3)在溶液中存在多種微粒形態(tài),25℃時(shí)各微粒的分布系數(shù)δ與溶液pH的關(guān)系如圖3所示。(分布系數(shù)即組分的平衡濃度占總濃度的分?jǐn)?shù))
①將KOH滴入H2SeO3溶液中,當(dāng)pH達(dá)到2.0時(shí),發(fā)生反應(yīng)的離子方程式是。
②25℃時(shí),KHSeO3溶液的pH<7,通過(guò)計(jì)算和必要的文字加以解釋?zhuān)?!--BA-->。
③已知硒酸的電離方程式為:H2SeO4═H++HSeO4-,HSeO4-?H++SeO42-。25℃時(shí),下列關(guān)于0.1mol?L-1NaHSeO4溶液的說(shuō)法錯(cuò)誤的是。
A.c(Na+)>c(HSeO4-)>c(H+)>c(SeO42-)>c(OH-)
B.c(H+)=c(OH-)+c(SeO42-)+c(H2SeO4)
C.c(HSeO4-)+c(SeO42-)+c(H2SeO4)=0.1mol?L-1
D.c(Na+)+c(H+)=c(HSeO4-)+2c(SeO42-)+c(OH-)發(fā)布:2024/6/27 10:35:59組卷:94引用:1難度:0.5 -
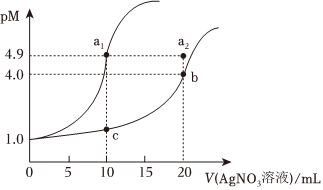 3.某溫度下,向10mL0.1mol?L-1NaCl溶液和10mL0.1mol?L-1K2CrO4溶液中分別滴加0.lmol?L-1AgNO3溶液。滴加過(guò)程中pM[-lgc(Cl-)或1gc()]與所加AgNO3溶液體積之間的關(guān)系如圖所示。已知Ag2CrO4為紅棕色沉淀。下列說(shuō)法錯(cuò)誤的是( )CrO2-4
3.某溫度下,向10mL0.1mol?L-1NaCl溶液和10mL0.1mol?L-1K2CrO4溶液中分別滴加0.lmol?L-1AgNO3溶液。滴加過(guò)程中pM[-lgc(Cl-)或1gc()]與所加AgNO3溶液體積之間的關(guān)系如圖所示。已知Ag2CrO4為紅棕色沉淀。下列說(shuō)法錯(cuò)誤的是( )CrO2-4A.該溫度下,Ksp(Ag2CrO4)=4×10-8 B.a(chǎn)1、b、c三點(diǎn)所示溶液中c(Ag+):a1>b>c C.若將上述NaCl溶液濃度改為0.2mol?L-1,則a1點(diǎn)會(huì)平移至a2點(diǎn) D.用AgNO3標(biāo)準(zhǔn)溶液滴定NaCl溶液時(shí),可用K2CrO4溶液作指示劑 發(fā)布:2024/4/20 14:35:0組卷:61引用:1難度:0.6
相關(guān)試卷


