2021-2022學年湖北省鄂州市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共15個小題,每題僅有一個正確答案。每小題3分)
-
1.為了進一步提高合成氨的生產效率,科研中具有開發價值的是( )
A.研究高溫下活性較大的催化劑 B.研究低溫下活性較大的催化劑 C.尋求氨的新來源 D.研制耐高溫高壓的新型材料建造合成塔 組卷:81引用:8難度:0.9 -
2.向一個密閉容器中充入1molN2和3molH2,在一定條件下使其發生反應生成NH3。達到平衡時,下列說法中正確的是( )
A.N2、H2和NH3的物質的量濃度之比為1:3:2 B.N2完全轉化為NH3 C.正反應速率和逆反應速率都為零 D.單位時間內消耗amolN2,同時消耗2amolNH3 組卷:36引用:3難度:0.7 -
3.現有四種元素的基態原子的電子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5。則下列有關比較中正確的是( )
A.第一電離能:④>③>②>① B.原子半徑:④>③>②>① C.電負性:④>③>②>① D.最高正化合價:④>③=②>① 組卷:560引用:184難度:0.7 -
4.a、b、c、d是四種短周期元素。a、b、d同周期,c、d同主族。a的原子結構示意圖為
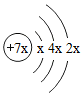 ,b與c形成的化合物的電子式為
,b與c形成的化合物的電子式為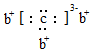 。下列說法中正確的是( )
。下列說法中正確的是( )A.原子半徑:a>c>d>b B.電負性:a>b>d>c C.原子序數:d>a>c>b D.最高價含氧酸的酸性:c>d>a 組卷:136引用:13難度:0.7 -
 5.研究發現液態有機物是比較理想的儲氫材料。甲苯儲氫反應
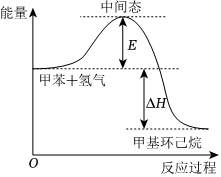
5.研究發現液態有機物是比較理想的儲氫材料。甲苯儲氫反應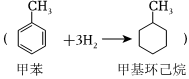 的能量變化如圖所示。
的能量變化如圖所示。
下列推斷不正確的是( )A.甲苯儲氫反應的原子利用率為100% B.甲苯儲氫反應是放熱反應 C.該反應的正反應活化能大于逆反應活化能 D.加入催化劑,不會改變反應熱 組卷:18引用:2難度:0.9 -
6.要增大 Zn 和稀 H2SO4間置換反應的速率,下列措施正確的是( )
A.使用高純度的鋅粒 B.使用濃H2SO4 C.使用小顆粒的鋅粒 D.使用濃HNO3 組卷:5引用:4難度:0.7 -
7.室溫下,下列各組離子在指定溶液中能大量共存的是( )
A. =10-12的溶液:NH4+、Cu2+、NO3-、SO42-c(OH-)c(H+)B.0.1mol?L-1的氨水:Cu2+、Na+、SO42-、NO3- C.1mol?L-1的NaClO溶液:Fe2+、Al3+、NO3-、I- D.0.1mol?L-1的NaHCO3溶液:K+、Na+、NO3-、OH- 組卷:54引用:5難度:0.6
二、非選擇題共55分
-
20.二甲醚是一種重要的清潔燃料,也可替代氟利昂作制冷劑,對臭氧層無破壞作用。
(1)利用水煤氣合成二甲醚的三步反應如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ/mol
總反應:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=。一定條件下的密閉容器中,該總反應達到平衡。要提高CO的平衡轉化率,下列選項中可以采取的措施是:。(填序號)
a.高溫高壓
b.加入催化劑
c.減少CO2的濃度
d.增加CO的濃度
e.分離出二甲醚
(2)已知上述(1)中反應②2CH3OH(g)?CH3OCH3(g)+H2O(g)在某溫度下的平衡常數為100.此溫度下在10L密閉容器中加入CH3OH,反應到某時刻測得容器中各組分的物質的量如表:
①比較此時正、逆反應速率的大小:v正物質 CH3OH CH3OCH3 H2O 物質的量/(mol) 4.0 6.0 6.0 v逆.(填“>”、“<”或“=”)
②若在此密閉容器中開始加入21mol CH3OH,則達到平衡時c(CH3OH)=。組卷:16引用:2難度:0.7 -
21.工業廢水中常含有一定量的Cr2O72-和CrO42-,它們會對人類及生態系統產生很大的傷害,必須進行處理。常用的處理方法有兩種。
方法1:還原沉淀法。該法的工藝流程為:CrO2-4Cr2OH+①轉化2-7Cr3+Fe2+②還原Cr(OH)3↓OH-③沉淀
(1)流程第①步存在平衡:2CrO42-+2H+?Cr2O72-+H2O,能說明第①步反應達平衡狀態的是。(填序號)
A.Cr2O72-和CrO42-的濃度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的顏色不變
(2)流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)。常溫下Cr(OH)3的溶度積Ksp=10-32,當c(Cr3+)降至10-5mol/L時溶液的pH為。
方法2:電解法
該法用Fe做電極電解含Cr2O72-的酸性廢水,隨著電解進行,在陰極附近溶液pH升高,產生Cr(OH)3沉淀。請用電極反應方程式解釋下列原因:
(3)用Fe做電極的原因是,在陰極附近溶液pH升高的原因是。組卷:88引用:2難度:0.6


