當(dāng)前位置:
知識點挑題
請展開查看知識點列表
>
<
更多>>
 已完結(jié)
已完結(jié)
|
期末復(fù)習(xí)
典型試卷
考前必刷
瀏覽次數(shù):809
更新:2025年06月03日
|
 已完結(jié)
已完結(jié)
|
熱點預(yù)測
高考復(fù)習(xí)
難題搶練
瀏覽次數(shù):1117
更新:2025年05月26日
|
381.根據(jù)構(gòu)造原理寫出下列基態(tài)原子或離子的電子排布式。
(1)A元素原子的M層電子數(shù)是L層電子數(shù)的一半。。
(2)B元素原子的最外層電子數(shù)是次外層電子數(shù)的1.5倍。。
(3)基態(tài)N3-,Ni2+、Fe3+的電子排布式分別為,,。發(fā)布:2024/12/30 19:0:1組卷:4引用:2難度:0.6382.寫出下列化合物的電子式:
水:二氧化碳:過氧化鈉:.發(fā)布:2024/12/30 19:0:1組卷:68引用:2難度:0.5383.下列有關(guān)甲烷的取代反應(yīng)的敘述正確的是( )
A.甲烷與氯氣的物質(zhì)的量之比為1:1,混合發(fā)生取代反應(yīng)只生成CH3Cl B.甲烷與氯氣的取代反應(yīng),生成的產(chǎn)物中CH3Cl最多 C.甲烷與氯氣的取代反應(yīng)生成的產(chǎn)物為混合物 D.1mol甲烷生成CCl4最多消耗2mol氯氣 發(fā)布:2024/12/30 19:0:1組卷:146引用:7難度:0.9384.反應(yīng)N2(g)+3H2(g)?2NH3(g)△H<0,若在恒壓絕熱容器中發(fā)生,下列選項表明反應(yīng)一定已達(dá)平衡狀態(tài)的是( )
A.容器內(nèi)的溫度不再變化 B.容器內(nèi)的壓強不再變化 C.相同時間內(nèi),斷開H-H鍵的數(shù)目和生成N-H鍵的數(shù)目相等 D.容器內(nèi)氣體的濃度c(N2):c(H2):c(NH3)=1:3:2 發(fā)布:2024/12/30 19:0:1組卷:256引用:34難度:0.5385.乙酸乙酯是重要的有機合成中間體,廣泛應(yīng)用于化學(xué)工業(yè)。實驗室利用如圖A裝置制備乙酸乙酯。
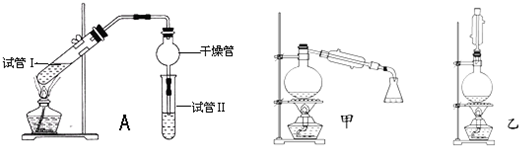
(1)若實驗中用乙酸和含18O的乙醇作用,該反應(yīng)的化學(xué)方程式是:。與教材采用的實驗裝置不同,此裝置中采用了球形干燥管,其作用是。
(2)為了證明濃硫酸在該反應(yīng)中起到了催化劑和吸水劑的作用,某同學(xué)利用上圖所示裝置進行了以下4個實驗。實驗開始先用酒精燈微熱3min,再加熱使之微微沸騰3min。實驗結(jié)束后充分振蕩小試管Ⅱ再測有機層的厚度,實驗記錄如下:
①實驗D的目的是與實驗C相對照,證明H+對酯化反應(yīng)具有催化作用。實驗D中應(yīng)加入鹽酸的體積和濃度分別是實驗編號 試管Ⅰ中試劑 試管Ⅱ中試劑 有機層的厚度/cm A 2mL乙醇、1mL乙酸、
1mL 18mol?L-1濃硫酸飽和Na2CO3溶液 3.0 B 2mL乙醇、1mL乙酸 0.1 C 2mL乙醇、1mL乙酸、
3mL 2mol?L-1H2SO40.6 D 2mL乙醇、1mL乙酸、鹽酸 0.6 mL和mol?L-1。
②分析實驗(填實驗編號)的數(shù)據(jù),可以推測出濃H2SO4的吸水性提高了乙酸乙酯的產(chǎn)率。
(3)若現(xiàn)有乙酸90g,乙醇138g發(fā)生酯化反應(yīng)得到88g乙酸乙酯,試計算該反應(yīng)的產(chǎn)率為。
(4)現(xiàn)擬分離含乙酸、乙醇和水的乙酸乙酯粗產(chǎn)品,如圖是分離操作步驟流程圖。圖中內(nèi)為適當(dāng)?shù)脑噭?!--BA-->內(nèi)為適當(dāng)?shù)姆蛛x方法。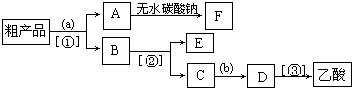
①試劑a是;分離方法②是,分離方法③是。分離方法①是分液,在具體操作中應(yīng)充分振蕩,然后靜置,待分層后(填標(biāo)號)。
A.直接將乙酸乙酯從分液漏斗上口倒出
B.直接將乙酸乙酯從分液漏斗下口放出
C.先將水層從分液漏斗的下口放出,再將乙酸乙酯從下口放出
D.先將水層從分液漏斗的下口放出,再將乙酸乙酯從上口放出
②在得到的A中加入無水碳酸鈉粉末,振蕩,目的是。
(5)為充分利用反應(yīng)物,甲、乙兩位同學(xué)分別設(shè)計了如圖甲、乙兩個裝置(乙同學(xué)待反應(yīng)完畢冷卻后,再用飽和碳酸鈉溶液提取燒瓶中的產(chǎn)物)。你認(rèn)為最合理的是。發(fā)布:2024/12/30 19:0:1組卷:84引用:3難度:0.1386.在光照條件下,分子式為C5H12的烷烴與氯氣發(fā)生取代反應(yīng),生成物中含有兩個氯原子且氯原子位于相鄰碳原子上的結(jié)構(gòu)最多有( )
A.3種 B.4種 C.5種 D.6種 發(fā)布:2024/12/30 19:0:1組卷:78引用:8難度:0.7387.美國化學(xué)家鮑林(L.Pauling)首先提出了電負(fù)性的概念。電負(fù)性也是元素的一種重要性質(zhì),電負(fù)性越大,其原子吸引電子的能力越強,在所形成的分子中成為帶負(fù)電荷的一方。下表給出的是原子序數(shù)小于20的16種元素的電負(fù)性數(shù)值:
元素 H Li Be B C N O F 電負(fù)性 2.1 1.0 1.5 2.0 2.5 3.0 3.5 4.0
請仔細(xì)分析,試回答下列問題。元素 Na Mg Al Si P S Cl K 電負(fù)性 0.9 1.2 1.5 1.8 2.1 2.5 3.0 0.8
(1)根據(jù)表中所給數(shù)據(jù)分析推測:同主族的不同元素的電負(fù)性變化的規(guī)律是;同周期中,電負(fù)性與原子半徑的關(guān)系為。
(2)預(yù)測周期表中電負(fù)性最大的元素應(yīng)為(填元素符號);估計鈣元素的電負(fù)性的取值范圍為<Ca<。
(3)預(yù)測周期表中,電負(fù)性最小的元素位于第周期族(放射性元素除外),其基態(tài)原子核外電子排布式可表示為,與氯形成的化合物化學(xué)式為,屬于(填“離子”或“共價”)化合物。發(fā)布:2024/12/30 19:0:1組卷:1引用:2難度:0.7388.化學(xué)促進了科技進步和社會發(fā)展。下列敘述中沒有涉及化學(xué)變化的是( )
A.《神農(nóng)本草經(jīng)》中記載的“石膽能化鐵為銅” B.利用“侯氏聯(lián)合制堿法”制備純堿 C.科學(xué)家成功將CO2轉(zhuǎn)化為淀粉或葡萄糖 D.北京冬奧會場館使用CO2跨臨界直冷制冰 發(fā)布:2024/12/30 19:0:1組卷:348引用:19難度:0.7389.下列說法正確的是( )
A.第一電離能越大的元素,其原子失電子能力越弱,得電子能力越強 B.第一電離能越大的金屬元素,金屬性就越弱 C.非金屬元素的第一電離能越大,電負(fù)性就越大 D.所有元素中He的第一電離能最大 發(fā)布:2024/12/30 19:0:1組卷:1引用:2難度:0.6390.下列說法正確的是( )
A.分子間作用力與化學(xué)鍵的大小相當(dāng) B.分子間作用力的大小遠(yuǎn)大于化學(xué)鍵,是一種很強的作用 C.分子間作用力主要影響物質(zhì)的化學(xué)性質(zhì) D.分子內(nèi)部的相鄰原子之間強烈的相互作用稱為化學(xué)鍵,而分子之間的也存在相互作用,稱為分子間作用力 發(fā)布:2024/12/30 19:0:1組卷:614引用:9難度:0.9



