當前位置:
知識點挑題
請展開查看知識點列表
>
<
更多>>
 更新中
更新中
|
期末復習
典型試卷
考前必刷
瀏覽次數:36
更新:2025年05月30日
|
 已完結
已完結
|
期末復習
專項訓練
能力提升
瀏覽次數:248
更新:2025年05月27日
|
2871.分類方法在化學學科的發展中起到了非常重要的作用.下列分類標準合理的是( )
①根據在水溶液中是否電離出H+將化合物分為酸和非酸;
②根據是否能與酸、堿反應生成鹽和水,把氧化物分了酸性氧化物、
堿性氧化物等;
③根據分散系是否具有丁達爾現象將分散系分為溶液、膠體和濁液;
④根據在水溶液里或熔融狀態下是否本身發生電離將化合物分為電解質和非電解質.A.①② B.③④ C.①③ D.②④ 發布:2024/12/21 8:0:2組卷:14引用:1難度:0.92872.下列實驗能達到目的的是( )
A.將NH4Cl溶液蒸干灼燒制備NH4Cl固體 B.只滴加氨水鑒別NaCl、AlCl3、MgCl2、Na2SO4四種溶液 C.用可見光束照射以區別溶液和膠體 D.用分液的方法分離酒精和水的混合物 發布:2024/12/21 8:0:2組卷:1引用:1難度:0.72873.下列有關“物質→類別”的對應關系正確的是( )
A.純堿→堿 B.氧化鐵→堿性氧化物 C.次氯酸→強酸 D.氫氧化鐵膠體→純凈物 發布:2024/12/21 8:0:2組卷:33引用:2難度:0.9 2874.實驗室中某些氣體的制取、收集、尾氣處理(或性質實驗)裝置如圖所示,用此裝置和如表中提供的物質完成相關實驗,合理的選項是( )
2874.實驗室中某些氣體的制取、收集、尾氣處理(或性質實驗)裝置如圖所示,用此裝置和如表中提供的物質完成相關實驗,合理的選項是( )選項 Ⅰ中的物質 Ⅱ中收集的氣體 Ⅲ中的物質 A. Cu和稀硝酸 NO NaOH溶液 B. 濃鹽酸和MnO2 Cl2 NaOH溶液 C. 亞硫酸鈉和濃硫酸 SO2 品紅溶液 D. CaCO3和稀硫酸 CO2 澄清石灰水 A.A B.B C.C D.D 發布:2024/12/21 8:0:2組卷:2引用:1難度:0.72875.實驗室制備下列氣體所選試劑、制備裝置及收集方法均正確的是( )

氣體 試劑 制備裝置 收集方法 A C2H4 乙醇、濃硫酸 c d B NH3 NH4Cl a e C Cl2 MnO2、濃鹽酸 b f D NO Cu、稀硝酸 b f A.A B.B C.C D.D 發布:2024/12/21 8:0:2組卷:49引用:1難度:0.8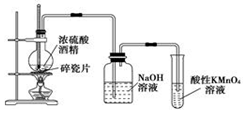 2876.實驗室用無水酒精和濃硫酸(體積比1:3)的混合加熱制乙烯氣體。某學習小組設計了如圖所示裝置,用于制取乙烯并驗證乙烯的性質。
2876.實驗室用無水酒精和濃硫酸(體積比1:3)的混合加熱制乙烯氣體。某學習小組設計了如圖所示裝置,用于制取乙烯并驗證乙烯的性質。
(1)觀察實驗裝置,判斷本實驗需要驗證乙烯的性質是。
(2)寫出生成乙烯的化學方程式。
(3)混合無水酒精和濃硫酸的具體操作方法是。
(4)在進行以下實驗時,不需要使用溫度計的是(填序號)。
A.制取溴苯 B.制取硝基苯C.蒸餾乙醇和水的混合物 D.制取乙酸乙酯
(5)加熱一段時間后,燒瓶中混合物顏色發黑。則NaOH溶液的作用是。
(6)有同學提出,如果利用溴水替代NaOH和酸性高錳酸鉀溶液,可以驗證乙烯是不飽和烴,利用化學方程式說明該方案的不合理性。發布:2024/12/21 8:0:2組卷:140引用:1難度:0.32877.下列說法正確的是( )
A.蛋白質在氧氣中完全燃燒轉化為水和二氧化碳 B.淀粉和纖維素分子式均可表示成(C6Hl005)n,它們互為同分異構體 C.與堿反應生成鹽和水的氧化物均為酸性氧化物 D.離子化合物中可能含有共價鍵 發布:2024/12/21 8:0:2組卷:11引用:1難度:0.92878.下列化學反應的離子方程式正確的是( )
A.向FeCl3溶液中加入Cu粉:2Fe3++3Cu═2Fe+3Cu2+ B.Cu和稀硝酸反應:Cu+2H++NO3-═Cu2++NO↑+H2O C.NaOH溶液中通入少量二氧化硫:SO2+2OH-═SO32-+H2O D.碳酸氫鈣溶液和氫氧化鈉溶液混合:HCO3-+OH-═CO32-+H2O 發布:2024/12/21 8:0:2組卷:2引用:1難度:0.72879.實驗室中某些氣體的制取、收集、尾氣處理(或性質實驗)裝置如圖所示,用此裝置和下表中提供的物質完成相關實驗,不合理的選項是( )
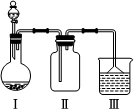
選項 Ⅰ中的物質 Ⅱ中收集的氣體 Ⅲ中的物質 A Cu和稀硝酸 NO2 Na2CO3溶液 B 濃鹽酸和KMnO4 Cl2 滴有酚酞的NaOH溶液 C Na2SO3和70%的硫酸 SO2 酸性KMnO4溶液 D 濃氨水和CaO NH3 酚酞溶液 A.A B.B C.C D.D 發布:2024/12/21 8:0:2組卷:1引用:0難度:0.62880.下列措施中,能減慢化學反應速率的是( )
A.用MnO2作H2O2分解反應的催化劑 B.用10%的H2SO4溶液代替30%的H2SO4溶液與鋅粒反應 C.把盛有Cu和稀硝酸的試管浸泡在熱水中 D.把石灰石固體研細后與鹽酸反應 發布:2024/12/21 8:0:2組卷:13引用:1難度:0.7



