當前位置:
知識點挑題
請展開查看知識點列表
>
<
更多>>
 更新中
更新中
|
期末復習
典型試卷
考前必刷
瀏覽次數:251
更新:2025年05月30日
|
 已完結
已完結
|
期末復習
專項訓練
能力提升
瀏覽次數:447
更新:2025年05月27日
|
2811.Murad等三位教授最早提出NO分子在人體內有獨特功能,近年來此領域研究有很大進展,因此這三位教授榮獲了1998年諾貝爾醫學及生理學獎.關于NO的下列敘述正確的是( )
A.NO可以由Cu和稀硝酸反應制得 B.NO不會造成空氣污染,是一種無害氣體 C.NO可以由N2在O2中燃燒制得 D.NO是紅棕色氣體 發布:2024/12/21 8:0:2組卷:8引用:1難度:0.92812.下列說法正確的是( )
A.由于水中存在氫鍵,所以水很穩定 B.能與酸反應生成鹽和水的氧化物一定是堿性氧化物 C.Na2O2中既含有離子鍵,又含有非極性鍵 D.由于C═O鍵是極性鍵,所以CO2是極性分子 發布:2024/12/21 8:0:2組卷:31引用:2難度:0.72813.選擇下列實驗方法分離物質,將分離方法的字母序號填在橫線上.
A.過濾法 B.分液法 C.蒸餾法 D.結晶法 E 萃取法 F 蒸發
(1)分離水和豆油的混合物;
(2)從含有硝酸鉀和少量氯化鉀的混合溶液中獲得硝酸鉀;
(3)分離飽和食鹽水和沙子的混合物;
(4)分離酒精和水的混合物.發布:2024/12/21 8:0:2組卷:5引用:1難度:0.52814.(填序號)下列物質中,A、硫酸鋇 B、濃硫酸 C、酒精溶液 D、氫氧化鈉E、銅 F、蔗糖 G、氨氣 H、硝酸鈉溶液
(1)屬于電解質的是,
(2)屬于非電解質的是.發布:2024/12/21 8:0:2組卷:17引用:1難度:0.32815.環己酮是工業上的一種重 要有機合成原料和溶劑。實驗室制備原理為:
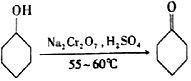 ,其反應的裝置示意圖如圖1(夾持裝置加熱裝置略去):
,其反應的裝置示意圖如圖1(夾持裝置加熱裝置略去):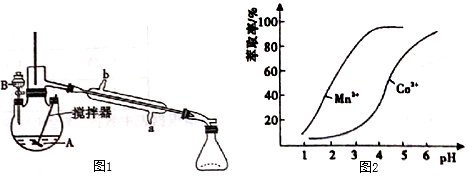
已知:
(注:括號中的數據表示該有機物與水形成的具有固定組成的恒沸物的沸點)物質 沸點(℃) 密度(g?cm-3,20℃) 溶解性 環己醇 161.1(97.8) 0.962 能溶于水 環己酮 155.6(95) 0.948 微溶于水
(1)制備產品。通過儀器B( 填儀器名稱)將酸性Na2Cr2O7和H2SO4混合溶液加到盛有環己醇的三頸燒瓶A中,通過( 填序號)方法加熱到55-60℃進行反應。
a.酒精燈加熱 b.油浴加熱 c.水浴加熱
(2)分離粗品。反應完成后,加入適量水,蒸餾,收集95-100℃的餾分(主要含環己酮粗品和水的混合物),試解釋無法分離環己酮和水的原因是。
(3)提純環己酮。
①在收集到的粗品中加NaCl固體至飽和,靜置,分液。加入NaCl固體的作用是。
②加入無水MgSO4固體,除去有機物中(填物質名稱)。
③過濾,蒸餾,收集151-156℃餾分,得到精品。
(4)下列關于實驗的敘述中,錯誤的是。
A.冷凝管的冷水應該從b進從a出
B.實驗開始時,溫度計水銀球應插入反應液中,便于控制反應液的溫度
C.裝置B中也可加入Na2Cr2O7和稀鹽酸混合溶液
D.反應過程中,需不斷攪拌
(5)利用環己酮做萃取劑可分離含Co2+、Mn2+的溶液,根據圖2信息可判斷,將pH范圍控制在左右時可分離出Mn2+。發布:2024/12/21 8:0:2組卷:13引用:1難度:0.52816.實驗室制備下列氣體所選試劑、制備裝置及收集方法均正確的是( )

氣體 試劑 制備裝置 收集方法 A CO2 石灰石+稀鹽酸 b c B NO Cu+稀硝酸 b c C O2 KMnO4 a d D H2 Zn+稀HNO3 b d A.A B.B C.C D.D 發布:2024/12/21 8:0:2組卷:15引用:1難度:0.72817.下列有關概念的說法中正確的是( )
A.在101KPa下,1mol物質完全燃燒的反應熱叫做該物質的熱值 B.在化學反應中,能量較高、能發生碰撞的分子稱為活化分子 C.具有相同質子數不同中子數的核素互稱同素異形體 D.既可以與酸反應又可以與堿反應生成鹽和水的氧化物稱為兩性氧化物 發布:2024/12/21 8:0:2組卷:23引用:4難度:0.72818.下列實驗方案能達到目的的是( )
A.用Cu和稀硝酸反應制備少量H2 B.電解熔融的氧化鋁可制得金屬鋁 C.用淀粉溶液檢驗碘化鉀溶液中的碘元素 D.NaOH溶液鑒別NH4Cl溶液和(NH4)2SO4溶液 發布:2024/12/21 8:0:2組卷:2引用:1難度:0.62819.下列對物質分類的歸納中,錯誤的是( )
A.蔗糖、酒精、甲烷等這類含碳化合物屬于有機物 B.由金屬離子和酸根離子組成的化合物稱為鹽 C.能電離出氫離子的化合物一定為酸 D.與酸反應,只生成鹽和水的氧化物,通常稱為堿性氧化物 發布:2024/12/21 8:0:2組卷:13引用:1難度:0.92820.化學工藝中倡導無污染的綠色化學是一場新的技術革命.若使用單質銅制硝酸銅,下列方案中,耗用原料最經濟,而且對環境幾乎沒有污染的是( )
A.Cu和稀硝酸反應制Cu(NO3)2 B.Cu和濃硝酸反應制Cu(NO3)2 C.銅在空氣中受熱轉化為CuO,再溶于稀硝酸制Cu(NO3)2 D.銅在氧氣中受熱轉化為CuO,再溶于濃硝酸制Cu(NO3)2 發布:2024/12/21 8:0:2組卷:31引用:1難度:0.9



