某化學(xué)興趣小組為比較稀鹽酸和稀CH3COOH溶液酸性的相對(duì)強(qiáng)弱,設(shè)計(jì)了如下實(shí)驗(yàn)方案,實(shí)驗(yàn)裝置如圖所示(夾持儀器已略去).
實(shí)驗(yàn)方案:在兩試管中分別加入過(guò)量鎂條,同時(shí)將兩注射器中的溶液注入相應(yīng)試管中,觀察產(chǎn)生氫氣的速率和體積.
請(qǐng)回答下列問(wèn)題:
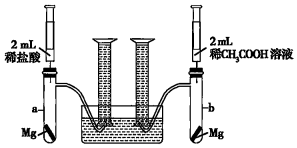
(1)在上述實(shí)驗(yàn)方案中有一明顯缺陷,該缺陷是 沒(méi)有說(shuō)明兩種酸的物質(zhì)的量濃度沒(méi)有說(shuō)明兩種酸的物質(zhì)的量濃度。
(2)在缺陷已經(jīng)得到改正的前提下,反應(yīng)起始時(shí),aa(填“a”或“b”)中產(chǎn)生氫氣的速率較快;最終產(chǎn)生氫氣的體積 相等相等。(填“相等”或“不相等”)
(3)最終發(fā)現(xiàn),實(shí)驗(yàn)中產(chǎn)生氫氣的體積比理論值大,可能原因是 鎂與酸反應(yīng)放熱,導(dǎo)致過(guò)量的鎂與水反應(yīng)產(chǎn)生部分氫氣鎂與酸反應(yīng)放熱,導(dǎo)致過(guò)量的鎂與水反應(yīng)產(chǎn)生部分氫氣。
(4)通過(guò)比較起始反應(yīng)速率可得出的結(jié)論是 等物質(zhì)的量濃度的稀鹽酸的酸性強(qiáng)于稀醋酸溶液的酸性等物質(zhì)的量濃度的稀鹽酸的酸性強(qiáng)于稀醋酸溶液的酸性。
【考點(diǎn)】比較弱酸的相對(duì)強(qiáng)弱的實(shí)驗(yàn).
【答案】沒(méi)有說(shuō)明兩種酸的物質(zhì)的量濃度;a;相等;鎂與酸反應(yīng)放熱,導(dǎo)致過(guò)量的鎂與水反應(yīng)產(chǎn)生部分氫氣;等物質(zhì)的量濃度的稀鹽酸的酸性強(qiáng)于稀醋酸溶液的酸性
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/8/16 0:0:1組卷:9引用:3難度:0.5
相似題
-
1.某研究性學(xué)習(xí)小組為了探究醋酸的電離情況,進(jìn)行了如下實(shí)驗(yàn).
實(shí)驗(yàn)一:配制并標(biāo)定醋酸溶液的濃度
取冰醋酸配制250mL 0.2mol?L-1的醋酸溶液,用0.2mol?L-1的醋酸溶液稀釋成所需濃度的溶液,再用NaOH標(biāo)準(zhǔn)溶液對(duì)所配醋酸溶液的濃度進(jìn)行標(biāo)定.回答下列問(wèn)題:
(1)配制250mL 0.2mol?L-1醋酸溶液時(shí)需要用到的玻璃儀器有量筒、燒杯、玻璃棒、和
(2)為標(biāo)定某醋酸溶液的準(zhǔn)確濃度,用0.200 0mol?L-1的NaOH溶液對(duì)20.00mL醋酸溶液進(jìn)行滴定,使用滴定管時(shí)第一步操作的是,實(shí)驗(yàn)中使用的錐形瓶和堿式滴定管分別只用水洗滌則所測(cè)得的醋酸濃度分別會(huì)(填“偏大”、“偏小”或“不變”).
若幾次滴定消耗NaOH溶液的體積如下:
則該醋酸溶液的準(zhǔn)確濃度為實(shí)驗(yàn)序號(hào) 1 2 3 4 消耗NaOH溶液的體積(mL) 20.05 20.00 18.80 19.95 .
實(shí)驗(yàn)二:探究濃度對(duì)醋酸電離程度的影響
用pH計(jì)測(cè)定25℃時(shí)不同濃度的醋酸的pH,結(jié)果如下:回答下列問(wèn)題:
(1)根據(jù)表中數(shù)據(jù),可以得出醋酸是弱電解質(zhì)的結(jié)論,你認(rèn)為得出此結(jié)論的依據(jù)是:醋酸濃度(mol?L-1) 0.001 0 0.010 0 0.020 0 0.100 0 0.200 0 pH 3.88 3.38 3.23 2.88 2.73 ,寫(xiě)出醋酸電離的方程式.
(2)從表中的數(shù)據(jù),還可以得出另一結(jié)論:隨著醋酸濃度的減小,醋酸的電離程度將(填“增大”“減小”或“不變”).
實(shí)驗(yàn)三:探究溫度對(duì)醋酸電離程度的影響
請(qǐng)你設(shè)計(jì)一個(gè)實(shí)驗(yàn)完成該探究,請(qǐng)簡(jiǎn)述你的實(shí)驗(yàn)方案:.發(fā)布:2024/11/18 8:0:1組卷:27引用:1難度:0.5 -
2.SO2溶于水生成亞硫酸,亞硫酸的酸性強(qiáng)于次氯酸。選擇下面的裝置和藥品來(lái)探究亞硫酸與次氯酸的酸性強(qiáng)弱。儀器選擇、連接順序正確的是(SO2發(fā)生裝置已略去,且通入的SO2純凈)( )

A.→②→④ B.→①→③→②→④ C.→②→①→④→③ D.→①→④→② 發(fā)布:2024/12/30 4:30:1組卷:78引用:2難度:0.6 -
3.下列事實(shí)能說(shuō)明碳酸的酸性比乙酸弱的是( )
A.乙酸能發(fā)生酯化反應(yīng),而碳酸不能 B.碳酸和乙酸都能與堿反應(yīng) C.乙酸易揮發(fā),而碳酸不穩(wěn)定易分解 D.乙酸和Na2CO3反應(yīng)可放出CO2 發(fā)布:2024/12/30 7:30:1組卷:152引用:8難度:0.9


