當前位置:
試題詳情
某研究性學習小組為了探究醋酸的電離情況,進行了如下實驗.
實驗一:配制并標定醋酸溶液的濃度
取冰醋酸配制250mL 0.2mol?L-1的醋酸溶液,用0.2mol?L-1的醋酸溶液稀釋成所需濃度的溶液,再用NaOH標準溶液對所配醋酸溶液的濃度進行標定.回答下列問題:
(1)配制250mL 0.2mol?L-1醋酸溶液時需要用到的玻璃儀器有量筒、燒杯、玻璃棒、膠頭滴管膠頭滴管和250 mL容量瓶250 mL容量瓶
(2)為標定某醋酸溶液的準確濃度,用0.200 0mol?L-1的NaOH溶液對20.00mL醋酸溶液進行滴定,使用滴定管時第一步操作的是檢查是否漏液檢查是否漏液,實驗中使用的錐形瓶和堿式滴定管分別只用水洗滌則所測得的醋酸濃度分別會不變,偏大不變,偏大(填“偏大”、“偏小”或“不變”).
若幾次滴定消耗NaOH溶液的體積如下:
| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的體積(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
0.200 0 mol?L-1
0.200 0 mol?L-1
.實驗二:探究濃度對醋酸電離程度的影響
用pH計測定25℃時不同濃度的醋酸的pH,結果如下:回答下列問題:
| 醋酸濃度(mol?L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
0.010 0 mol?L-1醋酸的pH大于2或醋酸稀釋10倍時,pH的變化值小于1
0.010 0 mol?L-1醋酸的pH大于2或醋酸稀釋10倍時,pH的變化值小于1
,寫出醋酸電離的方程式CH3COOH?CH3COO-+H+
CH3COOH?CH3COO-+H+
.(2)從表中的數據,還可以得出另一結論:隨著醋酸濃度的減小,醋酸的電離程度將
增大
增大
(填“增大”“減小”或“不變”).實驗三:探究溫度對醋酸電離程度的影響
請你設計一個實驗完成該探究,請簡述你的實驗方案:
用pH計(或pH試紙)測定相同濃度的醋酸在幾種不同溫度時的pH
用pH計(或pH試紙)測定相同濃度的醋酸在幾種不同溫度時的pH
.【考點】比較弱酸的相對強弱的實驗.
【答案】膠頭滴管;250 mL容量瓶;檢查是否漏液;不變,偏大;0.200 0 mol?L-1;0.010 0 mol?L-1醋酸的pH大于2或醋酸稀釋10倍時,pH的變化值小于1;CH3COOH?CH3COO-+H+;增大;用pH計(或pH試紙)測定相同濃度的醋酸在幾種不同溫度時的pH
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/11/18 8:0:1組卷:27引用:1難度:0.5
相似題
-
1.下列事實能說明碳酸的酸性比乙酸弱的是( )
A.乙酸能發生酯化反應,而碳酸不能 B.碳酸和乙酸都能與堿反應 C.乙酸易揮發,而碳酸不穩定易分解 D.乙酸和Na2CO3反應可放出CO2 發布:2024/12/30 7:30:1組卷:152引用:8難度:0.9 -
2.SO2溶于水生成亞硫酸,亞硫酸的酸性強于次氯酸。選擇下面的裝置和藥品來探究亞硫酸與次氯酸的酸性強弱。儀器選擇、連接順序正確的是(SO2發生裝置已略去,且通入的SO2純凈)( )

A.→②→④ B.→①→③→②→④ C.→②→①→④→③ D.→①→④→② 發布:2024/12/30 4:30:1組卷:78引用:2難度:0.6 -
3.Ⅰ.室溫下,現有c(H+) 相同的醋酸甲和鹽酸乙:
(1)相同條件下,取等體積的甲、乙兩溶液,各稀釋100倍。稀釋后的溶液,其c(H+) 大小關系為:
甲乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲、乙兩溶液,分別與等濃度的NaOH稀溶液完全反應,則消耗的NaOH溶液的體積大小關系為V(甲)V(乙)。
Ⅱ.已知25℃時有關弱酸的電離平衡常數如下:
(1)25℃時,將20 mL 0.1 mol?L-1 CH3COOH溶液和20 mL 0.1 mol?L-1 HSCN溶液分別與20 mL 0.1 mol?L-1 NaHCO3溶液混合,實驗測得產生的氣體體積(V)隨時間(t)的變化如圖所示:弱酸化學式 HSCN CH3COOH HCN H2CO3 電離平衡常數 1.3×10-1 1.8×10-5 4.9×10-10 Ka1=4.3×10-7
Ka2=5.6×10-11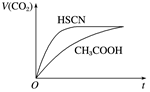
反應初始階段兩種溶液產生CO2氣體的速率存在明顯差異的原因是。
(2)若保持溫度不變,在醋酸溶液中通入一定量氨氣,下列各量會變小的是(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸電離平衡常數
Ⅲ.(1)HClO4、H2SO4、HCl和HNO3都是強酸,其酸性在水溶液中差別不大。以下是某溫度下這四種酸在冰醋酸中的電離常數,下列說法不正確的是。
A.溫度會影響這四種酸在冰醋酸中的電離常數酸 HClO4 H2SO4 HCl HNO3 Ka 1.6×10-5 Ka1:6.3×10-9 1.6×10-9 4.2×10-10
B.在冰醋酸中HClO4是這四種酸中最強的酸
C.在冰醋酸中H2SO4的電離方程式為H2SO4═2H++SO42-
D.這四種酸在冰醋酸中都沒有完全電離,但仍屬于強電解質
(2)亞磷酸是二元中強酸,25℃時亞磷酸(H3PO3)的電離常數為K1=1×10-2、K2=2.6×10-7。
①試從電離平衡移動的角度解釋K1為什么比K2大。
②寫出亞磷酸的電離方程式(2步);。
③請設計一種方案,使之能通過直觀的實驗現象判斷醋酸的酸性強于H2S,該方案所用的試劑是,反應的化學方程式為。發布:2024/10/27 17:0:2組卷:38引用:2難度:0.6


