燃煤的煙氣中含有SO2,為了治理霧霾天氣,工廠采用多種方法實現煙氣脫硫。
Ⅰ.(1)“濕式吸收法”利用吸收劑與SO2發生反應從而脫硫。下列試劑中適合用作該法吸收劑的是aa。(填字母序號)
a.石灰乳
b.CaCl2溶液
(2)某工廠利用含SO2的煙氣處理含Cr2O72-的酸性廢水,吸收塔中反應后的鉻元素以Cr3+形式存在,具體流程如圖。
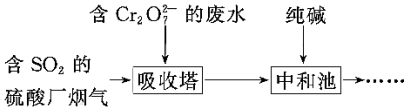
①用SO2處理含鉻廢水時,利用了SO2的還原還原性。
②吸收塔中發生反應的離子方程式為3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O。
Ⅱ.石灰-石膏法和燒堿法是常用的煙氣脫硫法。石灰-石膏法的吸收反應為Ca(OH)2+SO2═CaSO3↓+H2O.吸收產物亞硫酸鈣由管道輸送至氧化塔氧化,反應為2CaSO3+O2+4H2O═2CaSO4?2H2O.其流程如圖。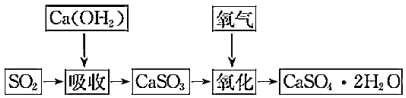
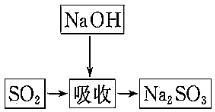
燒堿法的吸收反應為2NaOH+SO2═Na2SO3+H2O.該法的特點是氫氧化鈉堿性強、吸收快、效率高。其流程如圖。
已知:
| 試劑 | Ca(OH)2 | NaOH |
| 價格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
原料便宜,成本低
原料便宜,成本低
,缺點是吸收慢,效率低
吸收慢,效率低
。(4)某學習小組在石灰-石膏法和燒堿法的基礎上,設計一個改進的、能實現物料循環的煙氣脫硫方案,流程圖中的甲、乙、丙各是
NaOH
NaOH
、Ca(OH)2
Ca(OH)2
、Na2SO3
Na2SO3
(填化學式)。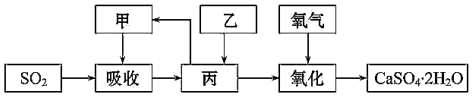
【考點】二氧化硫的污染及治理;常見的生活環境的污染及治理.
【答案】a;還原;3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O;原料便宜,成本低;吸收慢,效率低;NaOH;Ca(OH)2;Na2SO3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:55引用:2難度:0.6
相似題
-
1.利用石灰石和煙氣中的SO2反應生成石膏,可實現煙氣中脫除SO2。某研究性學習小組在實驗室利用如圖所示裝置制備煙氣(主要成分為SO2、CO2、N2、O2),并測定煙氣中SO2的體積分數以及研究煙氣通過轉化器的脫硫效率。請回答下列問題:
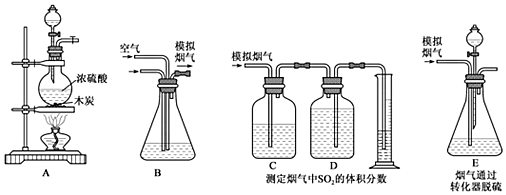
Ⅰ.模擬煙氣的制備。
(1)裝置A中發生反應的化學方程式:。
Ⅱ.測定煙氣中SO2的體積分數。
(2)將A中產生的氣體與空氣一起通過B裝置混合均勻,從而形成模擬煙氣。將部分模擬煙氣緩慢通過C、D裝置,其中C、D中盛有的藥品分別是、。(填序號)
a.KMnO4溶液
b.飽和NaHSO3溶液
c.飽和Na2CO3溶液
d.飽和NaHCO3溶液
裝置C的作用是:。
(3)①甲同學認為測定煙氣中SO2的體積分數的裝置中存在缺陷,你覺得應如何改進。
②乙同學根據模擬煙氣的流速amL?min-1和t1min后測得的量筒內液體的體積VmL,計算煙氣中二氧化硫的體積分數是。
Ⅲ.模擬煙氣通過轉化器的脫硫效率研究。
(4)E中溶液可以催化SO2與O2的反應生成SO42-,以達到脫硫的目的。若模擬煙氣仍以amL?min-1的流速通過轉化器E裝置,t2min后,向E裝置中加入酸化的BaCl2溶液,得到白色渾濁液,經過濾、洗滌、干燥、稱量,得到mg固體。若實驗測得的氣體體積已折算為標準狀況下的體積,則該轉化器的脫硫效率是。發布:2024/12/30 4:30:1組卷:80引用:2難度:0.6 -
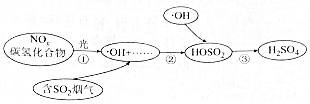 2.研究表明,硫酸型酸雨的形成與空氣中氮的氧化物和碳氫化合物有關,其部分過程如圖所示。下列說法錯誤的是( )
2.研究表明,硫酸型酸雨的形成與空氣中氮的氧化物和碳氫化合物有關,其部分過程如圖所示。下列說法錯誤的是( )A.優化能源結構和減少汽車尾氣排放可減少酸雨的形成 B.1mol?OH中含有10NA個電子(NA為阿伏加德羅常數的值) C.②③中硫元素的化合價均發生改變 D.光能促進酸雨的形成 發布:2024/12/30 7:0:1組卷:3引用:1難度:0.7 -
3.認識含硫物質的性質及轉化規律,能幫助我們更好地認識自然和保護環境。
(1)酸雨的形成原因,將SO2氣體通入蒸餾水中,取出部分溶液并用pH計測定其pH,每隔 10min讀數一次,所得數據如下:
隨著時間的推移,pH逐漸變小的原因是時間(min) 0 10 20 30 40 pH 4.95 4.94 4.86 4.85 4.85 (用化學方程式表示)。
(2)防治SO2對環境的污染。
①從物質分類角度看,SO2屬于酸性氧化物,工業上常用熟石灰將SO2轉化為亞硫酸鹽,寫出所得亞硫酸鹽的化學式:。
②從元素價態看,SO2中S元素為+4價,既具有氧化性,又具有還原性。用生物質熱解氣(主要成分為CO、CH4、H2)可將SO2在高溫下還原成單質硫。寫出CO還原SO2反應的化學方程式:。
(3)獲取空氣質量信息。某化學小組為了測定空氣中SO2的體積分數,做了如下實驗:取標準狀況下的空氣20.00L(含N2、O2、CO2、SO2),緩慢通過足量溴水,反應的化學方程式為:SO2+Br2+H2O→2HBr+H2SO4。在所得溶液中加入稍過量的BaCl2溶液,產生白色沉淀,過濾后將沉淀洗滌、干燥,稱得其質量為4.66g。空氣樣品中SO2的體積分數為。
(4)你認為減少酸雨可采取的措施是(填字母)。①少用煤作燃料②把工廠煙囪造高③化石燃料脫硫④在已酸化的土壤中加生石灰⑤開發新能源
A.①②③
B.②③④⑤
C.①③⑤
D.①③④⑤發布:2024/12/30 5:0:1組卷:62引用:3難度:0.8


