 甲醇是人們開發和利用的一種新能源。已知:
甲醇是人們開發和利用的一種新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8kJ/mol;
②CH3OH(l)+12O2(g)=CO2(g)+2H2(g)ΔH2=-192.9kJ/mol
(1)表示甲醇完全燃燒,燃燒熱的熱化學方程式為 CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)ΔH=-764.7kJ/molCH3OH(l)+32O2(g)=CO2(g)+2H2O(l)ΔH=-764.7kJ/mol。
(2)反應②中的能量變化如圖所示,則ΔH2=(E1-E2)kJ/mol(E1-E2)kJ/mol。(用E1、E2的相關式子表示)
(3)捕碳技術主要指捕獲CO2在降低溫室氣體排放中具有重要的作用。目前NH3和(NH4)2CO3已經被用作工業捕碳劑,它們與CO2可發生如下反應:
反應Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反應Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反應Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
則ΔH3與ΔH1、ΔH2與之間的關系為ΔH3=ΔH2×2-ΔH1ΔH2×2-ΔH1。
(4)拆開1mol氣態物質中某種共價鍵需要吸收的能量叫鍵能。從化學鍵的角度分析,化學反應的過程就是反應物的化學鍵的破壞和生成物的化學鍵的形成過程。在化學反應過程中,拆開化學鍵需要消耗能量,形成化學鍵又會釋放能量:
1
2
3
2
3
2
| 化學鍵 | H-H | N-H | N≡N |
| 鍵能/kJ/mol | 436 | 391 | 945 |
-93
-93
。(注明“+”或“-”)。【答案】CH3OH(l)+O2(g)=CO2(g)+2H2O(l)ΔH=-764.7kJ/mol;(E1-E2)kJ/mol;ΔH2×2-ΔH1;-93
3
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:5引用:1難度:0.8
相似題
-
1.下列與化學反應的能量變化有關的敘述正確的是( )
A.由石墨比金剛石穩定可知,C(金剛石)═C(石墨)△H<0 B.一個反應的反應物的總能量可能等于其生成物的總能量 C.有熱量變化的反應一定是化學反應 D.強酸與強堿的中和反應的熱化學方程式均可表示為H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1 發布:2025/1/6 6:0:5組卷:1引用:3難度:0.6 -
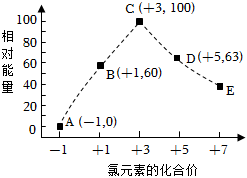 2.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )
2.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )A.A B.B C.C D.D 發布:2025/1/6 6:0:5組卷:0引用:1難度:0.9 -
3.下列說法不正確的是( )
A.CH3COOH 溶液加水稀釋后,溶液中 的值減小c(CH3COOH)c(CH3COO-)B.已知一定溫度下,醋酸溶液的物質的量濃度為c,電離度為α,Ka= .若加入少量醋酸鈉固體,則CH3COOH?CH3COO-+H+向左移動,α減小,Ka變小(cα)2c(1-α)C.實驗測得環己烷(l)、環己烯(l)和苯(l)的標準燃燒熱分別為-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以證明在苯分子中不存在獨立的碳碳雙鍵 D.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol.
CO(g)+O2(g)═CO2(g),△H=-283.0 kJ/mol.12
C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol.
則4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol發布:2025/1/1 8:0:2組卷:11引用:1難度:0.7


