2021-2022學年福建省泉州市永春一中高二(上)月考化學試卷(9月份)
發布:2024/4/20 14:35:0
一、選擇題(每題3分,共63分。每小題只有一項符合題目要求)
-
1.下列反應中.既屬于氧化還原反應同時又是吸熱反應的是( )
A.Ba(OH)2?8H2O與NH4Cl反應 B.灼熱的碳與高溫水蒸氣的反應 C.鋁與稀鹽酸 D.H2與O2的燃燒反應 組卷:47引用:7難度:0.7 -
2.下列說法中正確的是( )
A.在化學反應過程中,發生物質變化的同時不一定發生能量變化 B.生成物全部化學鍵形成時所釋放的能量大于破壞反應物全部化學鍵所吸收的能量時,反應為吸熱反應 C.生成物的總能量大于反應物的總能量時,反應吸熱,△H>0 D.△H的大小與熱化學方程式的計量系數無關 組卷:59引用:27難度:0.9 -
3.在電解水時,為了增強導電性,加入的電解質最好選用( )
A.HCl B.CuCl2 C.Na2SO4 D.CuSO4 組卷:13引用:7難度:0.7 -
4.下列說法錯誤的是( )
A.任何化學反應中都有化學鍵的變化 B.化學變化中的能量變化主要是由化學鍵的變化引起的 C.二次電池充電時電能轉化為化學能 D.燃料電池是將燃料燃燒釋放的熱能轉化為電能的裝置 組卷:3引用:2難度:0.7 -
5.在四個不同的容器中,在不同的條件下進行合成氨反應,根據下列在相同時間內測得的結果判斷,生成氨的反應速率最快的是( )
A.v(NH3)=0.05mol/(L?min) B.v(NH3)=0.2mol/(L?min) C.v(H2)=0.3mol/(L?min) D.v(H2)=0.4mol/(L?min) 組卷:5引用:1難度:0.5 -
6.反應C(s)+H2O (g)?CO(g)+H2(g)在一密閉容器中進行,下列條件的改變能加快反應速率是( )
A.增加C的量 B.將容器的體積縮小一半 C.保持容器體積不變,充入N2 D.保持壓強不變,充入He 組卷:96引用:3難度:0.7 -
7.根據以下3個熱化學方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)ΔH=-Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=-Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)ΔH=-Q3kJ/mol
判斷Q1、Q2、Q3三者關系正確的是( )A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3 組卷:838引用:174難度:0.5 -
8.有A、B、C、D四種金屬,當A、B組成原電池時,電子流動方向A→B;當A、D組成原電池時,A為正極;B與C構成原電池時,電極反應式為:C2++2e-→C,B-2e-→B2+則A、B、C、D金屬性由強到弱的順序為( )
A.A>B>C>D B.A>B>D>C C.D>A>B>C D.D>C>A>B 組卷:50引用:14難度:0.9
二、非選擇題(共37分)
-
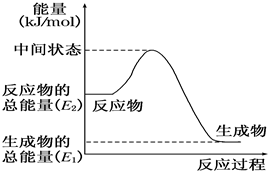 23.甲醇是人們開發和利用的一種新能源。已知:
23.甲醇是人們開發和利用的一種新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8kJ/mol;
②CH3OH(l)+O2(g)=CO2(g)+2H2(g)ΔH2=-192.9kJ/mol12
(1)表示甲醇完全燃燒,燃燒熱的熱化學方程式為。
(2)反應②中的能量變化如圖所示,則ΔH2=。(用E1、E2的相關式子表示)
(3)捕碳技術主要指捕獲CO2在降低溫室氣體排放中具有重要的作用。目前NH3和(NH4)2CO3已經被用作工業捕碳劑,它們與CO2可發生如下反應:
反應Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反應Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反應Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
則ΔH3與ΔH1、ΔH2與之間的關系為ΔH3=。
(4)拆開1mol氣態物質中某種共價鍵需要吸收的能量叫鍵能。從化學鍵的角度分析,化學反應的過程就是反應物的化學鍵的破壞和生成物的化學鍵的形成過程。在化學反應過程中,拆開化學鍵需要消耗能量,形成化學鍵又會釋放能量:
已知反應N2(g)+3H2(g)?2NH3(g) ΔH=akJ/mol,試根據表中所列鍵能數據估算a的值化學鍵 H-H N-H N≡N 鍵能/kJ/mol 436 391 945 。(注明“+”或“-”)。組卷:5引用:1難度:0.8 -
24.Ⅰ.用碳棒作電極,在Na+、Cu2+、Cl-、SO42-等離子中選出適當離子組成電解質,電解其溶液,寫出符合條件的一種電解質的化學式:
(1)當陰極放出H2,陽極放出O2時,電解質是;
(2)當陰極析出金屬,陽極放出O2時,電解質是;
(3)當陰極放出H2,陽極放出Cl2時,電解質是。
Ⅱ.某興趣小組的同學用如圖所示裝置研究有關電化學的問題(甲、乙、丙三池中溶質足量),當閉合該裝置的電鍵K時,觀察到電流計的指針發生了偏轉。請回答下列問題: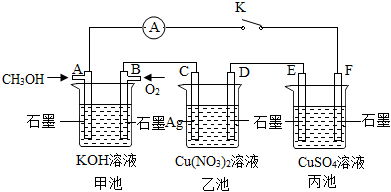
(4)甲池為(填“原電池”、“電解池”或“電鍍池”),A電極的電極反應式為。
(5)丙池中E電極為(填“正極”、“負極”、“陰極”或“陽極”),電極的電極反應式為。該池總反應的化學方程式為。
(6)當乙池中C極質量減輕10.8g時,甲池中B電極理論上消耗O2的體積為mL(標準狀況)。
(7)一段時間后,斷開電鍵K,下列物質能使丙池恢復到反應前濃度的是(填選項字母)。
A.Cu
B.CuO
C.Cu(OH)2
D.Cu2(OH)2CO3組卷:26引用:1難度:0.7


