實驗室從含碘廢液(除H2O外,含有CCl4、I2、I-等)中回收碘,實驗過程如圖1:

(1)向含碘廢液中加入稍過量的Na2SO3溶液,將廢液中的I2還原為I-,其離子方程式為SO32-+I2+H2O=2I-+2H++SO42-SO32-+I2+H2O=2I-+2H++SO42-;該操作將I2還原為I-的目的是使四氯化碳中的碘進入水層使四氯化碳中的碘進入水層。
(2)操作X的名稱為分液分液。
(3)氧化時,在三頸瓶中將含I-的水溶液用鹽酸調至pH約為2,緩慢通入Cl2,在40℃左右反應(實驗裝置如圖所示)。實驗控制在較低溫度下進行的原因是使氯氣在溶液中有較大的溶解度使氯氣在溶液中有較大的溶解度;儀器a的名稱為球形冷凝管球形冷凝管;儀器b中盛放的溶液為NaOH溶液NaOH溶液。
(4)已知:5SO32-+2IO3-+2H+=I2+5SO42-+H2O;某含碘廢水(pH約為8)中一定存在I2,可能存在I-、IO3-中的一種或兩種。請補充完整檢驗含碘廢水中是否含有I-、IO3-的實驗方案(實驗中可供選擇的試劑:稀鹽酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。
①取適量含碘廢水用CCl4多次萃取、分液,直到水層用淀粉溶液檢驗不出有碘單質存在;
②從水層取少量溶液,加入1~2mL淀粉溶液,加入鹽酸酸化,滴加FeCl3溶液,若溶液變藍色,說明廢水中含有I-,否則不含I-從水層取少量溶液,加入1~2mL淀粉溶液,加入鹽酸酸化,滴加FeCl3溶液,若溶液變藍色,說明廢水中含有I-,否則不含I-;
③另從水層中取少量溶液,加入1~2mL淀粉溶液,加鹽酸酸化后,滴加Na2SO3溶液,若溶液變藍說明廢水中含有IO3-;否則說明廢水中不含有IO3-。
(5)二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑和水處理劑。現用氧化酸性含廢液回收碘。完成ClO2氧化I-的離子方程式:□ClO2+□I-+□8H+8H+=□I2+□Cl-+□4H2O4H2O。
(6)“碘量法”是一種測定S2-含量的有效方法。立德粉ZnS?BaSO4是一種常用的白色顏料,制備過程中會加入可溶性的BaS,現用“碘量法”來測定立德粉樣品中S2-的含量。稱取m g樣品,置于碘量瓶中,移取25.00 mL 0.1000 mol/L 的I2-KI溶液于其中,并加入乙酸溶液,密閉,置暗處反應5min,有單質硫析出。以淀粉為指示劑,過量的I2用0.1000 mol/L Na2S2O3 滴定,反應式為I2+2S2O32-═2I-+S4O62-.測定消耗Na2S2O3溶液體積V mL.立德粉樣品S2-含量為(25.00-12V)×0.1000×32m×1000×100%(25.00-12V)×0.1000×32m×1000×100%(寫出表達式)
(
25
.
00
-
1
2
V
)
×
0
.
1000
×
32
m
×
1000
(
25
.
00
-
1
2
V
)
×
0
.
1000
×
32
m
×
1000
【考點】物質分離和提純的方法和基本操作綜合應用.
【答案】SO32-+I2+H2O=2I-+2H++SO42-;使四氯化碳中的碘進入水層;分液;使氯氣在溶液中有較大的溶解度;球形冷凝管;NaOH溶液;從水層取少量溶液,加入1~2mL淀粉溶液,加入鹽酸酸化,滴加FeCl3溶液,若溶液變藍色,說明廢水中含有I-,否則不含I-;8H+;4H2O;×100%
(
25
.
00
-
1
2
V
)
×
0
.
1000
×
32
m
×
1000
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:36引用:1難度:0.4
相似題
-
1.我國青藏高原的鹽湖中蘊藏著豐富的鋰資源,已探明的儲量約三千萬噸,碳酸鋰制備高純金屬鋰的一種工藝流程如圖。下列有關說法錯誤的是( )
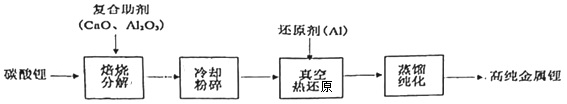
A.金屬鋰可保存在煤油中 B.使用復合助劑有利于碳酸鋰的分解 C.“粉碎”是為了增加接觸面積,加快反應速率 D.真空熱還原發生的主要化學反應為2Al+3Li2O 6Li+Al2O3高溫發布:2025/1/6 7:30:5組卷:28引用:2難度:0.9 -
2.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3等雜質)。用該燒渣制取藥用輔料-紅氧化鐵的工藝流程如圖:
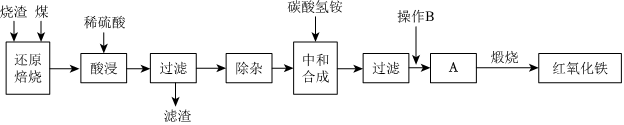
(1)在“還原焙燒”中產生的有毒氣體可能有。
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示)。
(3)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則操作B是。
(4)煅燒A的反應方程式是。
(5)ag燒渣經過上述工藝可得紅氧化鐵bg。藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示)。發布:2025/1/19 8:0:1組卷:30引用:1難度:0.5 -
3.查閱資料:CaO、MgO在高溫下與C難反應,但能與SiO2反應.硫鐵礦燒渣是一種工業廢渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質),該燒渣可用于制取氧化鐵,具體化工生產工藝流程如下:
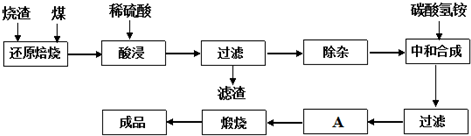
(1)焙燒時產生的主要有害氣體是.
(2)若在空氣中“酸浸”時間過長,溶液中Fe2+含量將下降,其原因是:(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗Fe3+已經除盡的試劑是(除KSCN外).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.發布:2025/1/19 8:0:1組卷:12引用:1難度:0.1


