2019-2020學年黑龍江省大慶市鐵人中學高三(上)開學化學試卷
發布:2024/12/22 22:0:2
一、選擇題(本題共21小題,每小題只有一個選項正確,每小題2分,共42分)
-
1.我國古代典籍中有“石膽……淺碧色,燒之變白色者真”的記載,其中石膽是指( )
A.CuSO4?H2O B.FeSO4?7H2O C.ZnSO4?7H2O D.KAl(SO4)2?12H2O 組卷:24引用:1難度:0.8 -
2.化學與生活密切相關,下列有關說法正確的是( )
A.漂白粉即可做漂白棉麻紙張的漂白劑,又可做游泳池及環境的消毒劑和凈水劑 B.純凈的二氧化硅是制備光導纖維的原料 C.燃放煙花呈現出多種顏色是由于煙花中添加了Na、Cu、Fe、Pt等金屬的單質 D.合金材料的組成元素一定全部是金屬元素 組卷:25引用:1難度:0.6 -
3.下列有關銅的化合物說法正確的是( )
A.根據鐵比銅金屬性強,在實際應用中可用FeCl3腐蝕Cu刻制印刷電路板 B.CuSO4溶液與H2S溶液反應的離子方程式為:Cu2++S2-═CuS↓ C.用稀鹽酸除去銅銹的離子方程式為CuO+2H+═Cu2++H2O D.化學反應:CuO+CO Cu+CO2的實驗現象為黑色固體變成紅色固體△組卷:87引用:3難度:0.7 -
4.下列說法正確的是( )
A.Cl2、SO2均能使品紅溶液褪色且褪色的原理相同 B.常溫下,銅片放入濃硫酸中,無明顯變化,說明銅在冷的濃硫酸中發生鈍化 C.Fe與稀HNO3、稀H2SO4反應均有氣泡產生,說明Fe與兩種酸均發生置換反應 D.銨鹽與濃的強堿的溶液共熱都能產生氨氣 組卷:37引用:2難度:0.7 -
5.下列關于鹵族元素的遞變規律不正確的是( )
A.F2、Cl2、Br2、I2的氧化性逐漸減弱 B.HF、HCl、HBr、HI的熱穩定性逐漸減弱 C.F-、Cl-、Br-、I-的還原性逐漸增強,顏色逐漸變深 D.F2、Cl2、Br2、I2的密度逐漸增大,熔沸點逐漸升高 組卷:87引用:2難度:0.5 -
6.下列關于物質應用的說法錯誤的是( )
A.玻璃容器可長期盛放各種酸 B.純堿可用于清洗油污 C.濃氨水可檢驗氯氣管道漏氣 D.Na2S可除去污水中的Cu2+ 組卷:795引用:12難度:0.7 -
7.下列有關實驗裝置進行的相應實驗,不能達到實驗目的的是( )

A.用圖1所示裝置除去Cl2中含有的少量HCl B.用圖2所示裝置蒸發KCl溶液制備無水KCl C.用圖3所示裝置可以完成“噴泉”實驗 D.用圖4所示裝置制取、收集干燥純凈的NH3 組卷:50引用:11難度:0.9 -
8.X、Y、Z是周期表中相鄰的三種短周期元素,它們的原子半徑依次減小,X與Z的核電荷數之比為3:4,X、Y、Z分別與氫元素能形成氫化物。下列敘述正確的是( )
A.Z是第二周期IVA族元素 B.X只有兩種同素異形體 C.元素的非金屬性:Z>Y>X D.X、Y、Z的氫化物沸點逐漸降低 組卷:7引用:1難度:0.6
二、解答題(共4小題,滿分52分)
-
24.釔的常見化合價為+3價,我國蘊藏著豐富的含釔礦石(Y2FeBe2Si2O10),工業上通過如下生產流程可獲得氧化釔。
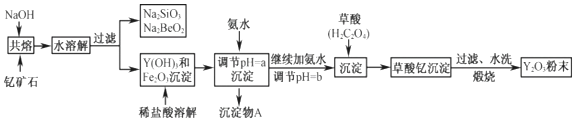
已知:①該流程中有關金屬離子形成氫氧化物沉淀時的pH見如表:
②在元素周期表中,鈹元素和鋁元素處于第二周期和第三周期的對角線位置,化學性質相似。離子 開始沉淀時的pH 完全沉淀時的pH Fe3+ 2.1 3.1 Y3+ 6.0 8.2
(1)寫出Na2SiO3的一種用途。
(2)若改用氧化物的形式表示Y2FeBe2Si2O10組成,則化學式為。
(3)根據元素周期表的知識判斷,常溫下,氯化鍶溶液pH7(填“大于”、“等于”或“小于”);寫出氯化鍶的電子式:。
(4)欲從Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
①最好選用鹽酸和兩種試劑,再通過必要的操作即可實現。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
②寫出Na2BeO2與足量鹽酸發生反應的離子方程式。
(5)為使Fe3+沉淀完全,用氨水調節pH=a時,a應控制在范圍內;繼續加氨水調節pH=b發生反應的離子方程式為;檢驗Fe3+是否沉淀完全的操作方法是:。
(6)煅燒草酸釔時發生分解反應,其固體產物為氧化釔,氣體產物能使澄清石灰水變渾濁。寫出草酸釔[Y2(C2O4)3?nH2O]煅燒的化學方程式。組卷:14引用:1難度:0.4 -
25.實驗室從含碘廢液(除H2O外,含有CCl4、I2、I-等)中回收碘,實驗過程如圖1:
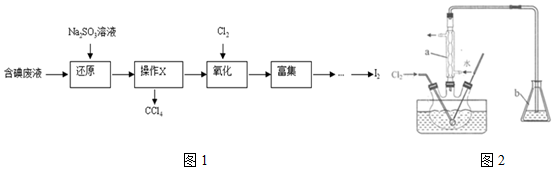
(1)向含碘廢液中加入稍過量的Na2SO3溶液,將廢液中的I2還原為I-,其離子方程式為;該操作將I2還原為I-的目的是。
(2)操作X的名稱為。
(3)氧化時,在三頸瓶中將含I-的水溶液用鹽酸調至pH約為2,緩慢通入Cl2,在40℃左右反應(實驗裝置如圖所示)。實驗控制在較低溫度下進行的原因是;儀器a的名稱為;儀器b中盛放的溶液為。
(4)已知:5SO32-+2IO3-+2H+=I2+5SO42-+H2O;某含碘廢水(pH約為8)中一定存在I2,可能存在I-、IO3-中的一種或兩種。請補充完整檢驗含碘廢水中是否含有I-、IO3-的實驗方案(實驗中可供選擇的試劑:稀鹽酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。
①取適量含碘廢水用CCl4多次萃取、分液,直到水層用淀粉溶液檢驗不出有碘單質存在;
②;
③另從水層中取少量溶液,加入1~2mL淀粉溶液,加鹽酸酸化后,滴加Na2SO3溶液,若溶液變藍說明廢水中含有IO3-;否則說明廢水中不含有IO3-。
(5)二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑和水處理劑。現用氧化酸性含廢液回收碘。完成ClO2氧化I-的離子方程式:□ClO2+□I-+□=□I2+□Cl-+□。
(6)“碘量法”是一種測定S2-含量的有效方法。立德粉ZnS?BaSO4是一種常用的白色顏料,制備過程中會加入可溶性的BaS,現用“碘量法”來測定立德粉樣品中S2-的含量。稱取m g樣品,置于碘量瓶中,移取25.00 mL 0.1000 mol/L 的I2-KI溶液于其中,并加入乙酸溶液,密閉,置暗處反應5min,有單質硫析出。以淀粉為指示劑,過量的I2用0.1000 mol/L Na2S2O3 滴定,反應式為I2+2S2O32-═2I-+S4O62-.測定消耗Na2S2O3溶液體積V mL.立德粉樣品S2-含量為(寫出表達式)組卷:36引用:1難度:0.4


