在化學學習和研究中有很多方法可循,這些方法可以讓我們更好地認識化學。
(1)歸納法:木炭、蠟燭、硫、鎂條都能在氧氣中燃燒,請按要求歸納出上述物質在氧氣中燃燒的共同點:①能量變化:在燃燒過程中都 放放(選填“放”或“吸”)熱。
②反應類型:發生的反應都屬于 氧化氧化(選填“氧化”或“化合”)反應。寫出鎂條在氧氣中燃燒的化學反應方程式 2Mg+O2 點燃 2MgO2Mg+O2 點燃 2MgO。
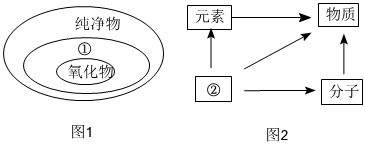
(2)模型法:圖1、圖2均表示概念間的邏輯關系,則圖1中①表示 化合物化合物,圖2中②表示 原子原子。
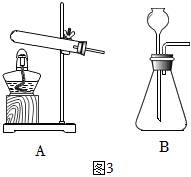
(3)演繹法:圖3中A、B裝置都可以用于實驗室制備O2,由此推測加熱氯化銨和熟石灰固體混合物制取氨氣,選取的發生裝置是 AA(選填“A”或“B”)。
(4)探究法:化學興趣小組對實驗室制取氧氣進行了如下探究。
Ⅰ、探究二氧化錳在過氧化氫分解反應中的作用
實驗1:在試管中加入5mL5%過氧化氫溶液,把帶火星的木條伸入試管,觀察現象。
實驗2:向上述試管中加入二氧化錳粉末,把帶火星的木條伸入試管,有大量氣泡冒出,帶火星的木條復燃。
實驗3:待上述試管中沒有現象發生時,重新加入過氧化氫溶液,把帶火星的木條伸入試管,觀察現象。
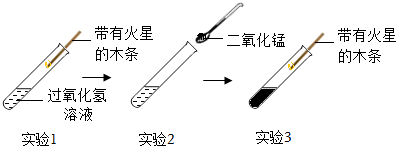
實驗4:探究催化劑的用量對過氧化氫分解速率的影響。每次實驗均用30mL10%的H2O2溶液,采用不同質量MnO2粉末做催化劑,測定收集到500mL氧氣所用的時間,結果如下:
點燃
點燃
| 實驗序號 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| MnO2粉末用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用時間/s | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 |
過氧化氫分解的速率很慢
過氧化氫分解的速率很慢
。(b)寫出實驗2發生反應的化學方程式
2H2O2 2H2O+O2↑
M
n
O
2
2H2O2 2H2O+O2↑
。M
n
O
2
(c)實驗3的實驗目的是
驗證反應前后過氧化氫溶液的化學性質是否改變
驗證反應前后過氧化氫溶液的化學性質是否改變
。(d)由實驗4的實驗結果可得出的結論是
加入的催化劑越多,反應速率越快
加入的催化劑越多,反應速率越快
。Ⅱ、探究高錳酸鉀分解制取氧氣的得氧率
高錳酸鉀在用酒精燈加熱分解的過程中,可能發生如下三個反應:
①2KMnO4
△
②6KMnO4
△
③KMnO4
△
(e)根據反應①,計算15.8gKMnO4完全分解生成氧氣的質量是
1.6
1.6
g。(f)已知:得氧率=
生成氧氣的質量
反應前反應物的質量
③
③
(填反應序號)。【答案】放;氧化;2Mg+O2 2MgO;化合物;原子;A;過氧化氫分解的速率很慢;2H2O2 2H2O+O2↑;驗證反應前后過氧化氫溶液的化學性質是否改變;加入的催化劑越多,反應速率越快;1.6;③
點燃
M
n
O
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/10/2 13:0:1組卷:25引用:1難度:0.5
相似題
-
 1.Fenton法常用于處理含難降解有機物的工業廢水。其原理是利用Fe2+和H2O2的反應產生能降解污染物的活性成分。現運用該方法降解有機污染物p-CP,探究有關因素對降解反應速率的影響。實驗探究:控制p-CP的初始濃度相同,實驗溫度恒定在25℃或40℃(其余實驗條件見下表)。
1.Fenton法常用于處理含難降解有機物的工業廢水。其原理是利用Fe2+和H2O2的反應產生能降解污染物的活性成分。現運用該方法降解有機污染物p-CP,探究有關因素對降解反應速率的影響。實驗探究:控制p-CP的初始濃度相同,實驗溫度恒定在25℃或40℃(其余實驗條件見下表)。
(1)請結合上述介紹將表中空格補充完整。
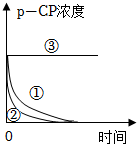
(2)實驗測得p-CP的濃度隨時間變化的關系如圖所示,根據實驗①、②圖像可得出結論:實驗編號 實驗目的 溫度/℃
pH濃度/(mg?L﹣1) H2O2 Fe2+ ① 為②③提供參照 25 3 204 16.8 ② 探究溫度對降解反應速率的影響
3 204 16.8 ③ 探究溶液pH對降解反應速率的影響 25 10 204 16.8 。
(3)為測定不同時間內有機物降解的濃度,需在不同時間從反應器中取樣,并使所取樣品中的降解反應立即停止下來。根據本題信息,將樣品從反應器中取出后應立即將其放入某藥品中,反應會迅速停止,該藥品可能是。
A鹽酸溶液 B氫氧化鈉溶液 C稀硫酸溶液 D碳酸鈉溶液發布:2024/11/25 8:0:2組卷:4引用:0難度:0.3 -
2.據圖1裝置圖回答問題
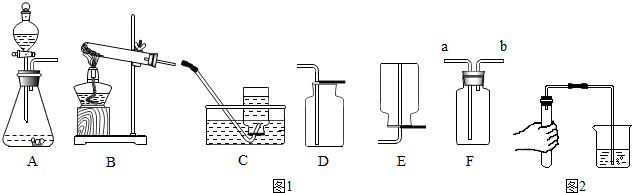
(1)甲同學用氯酸鉀和二氧化錳共熱制備和收集氧氣,他應選用的氣體發生裝置是(填序號).他用裝置C來收集的原因是,當看到導管口的時他才開始收集氧氣.
(2)該同學用如圖2所示的方法進行氣密性檢查,如果裝置不漏氣,可以看到,將手松開一段時間后(導管仍插入水中),可以看到導管中會形成一段水柱.
(3)因為氧氣的密度比空氣的稍大,所以還可以選用(填序號)來收集氧氣,其驗滿的方法是.
(4)老師提醒可以用F(萬能瓶)來收集氣體,則甲同學應將發生裝置的導管與F的導管(選填a或b)相連接.
(5)乙同學稱取一定質量的KMnO4固體放入大試管中,將溫度控制在250℃加熱制取O2.實驗結束時,這位同學發現用排水法收集到的O2大于理論產量.針對這一現象,同學們進行了如下探究:
【提出猜想】猜想Ⅰ:反應生成的二氧化錳(MnO2)分解放出O2;
猜想Ⅱ:反應生成的錳酸鉀(K2MnO4)分解放出O2;
【實驗驗證】同學們分成兩組,分別進行下列實驗:
第一組同學取一定質量的MnO2,在250℃條件下加熱一段時間,冷卻后測得MnO2的質量不變,則猜想(選填Ⅰ或Ⅱ)錯誤;
第二組同學取K2MnO4在250℃條件下加熱,沒有用測定質量的方法得出了猜想Ⅱ正確的結論.該組同學選擇的實驗方法是.
【拓展延伸】實驗發現,KClO3固體加熱制取O2的反應速率很慢,但如果將KMnO4固體與KClO3固體混合加熱,則KClO3的分解速率大大加快,請說明KMnO4在KClO3的分解反應中是否作催化劑,為什么?.
(6)丙同學選擇用雙氧水和二氧化錳混合來制氧氣,則他應選用的氣體發生裝置是(填序號).以下是他探究影響該反應速率因素的相關實驗數據.
通過以上實驗數據的分析,可知,過氧化氫分解制氧氣的化學反應速率與實驗
序號H2O2溶液濃度% H2O2溶液體積/mL 溫度℃ MnO2用量/g 收集到的
氧氣體積/mL反應所需的
時間/s① 5 1 20 1 30.29 ② 5 1 20 0.1 4 16.75 ③ 15 1 20 0.1 4 6.04 ④ 30 1 55 2 10.76 、、等因素有關;發生裝置中的(填儀器名稱)也可以幫助控制反應的速率.發布:2024/12/18 8:0:1組卷:12引用:2難度:0.5 -
3.下列探究影響化學反應速率因素的實驗中,實驗方案正確的是( )
選項 影響因素 實驗方案 A 接觸面積 將1g塊狀石灰石和20mL10%的稀鹽酸、1g粉末狀石灰石與20mL10%的稀硫酸混合,比較產生氣泡的快慢 B 催化劑的種類 將0.5g二氧化錳、1g氧化鐵分別與10mL6%的過氧化氫溶液混合,比較產生氣泡的快慢 C 反應物的種類 分別將木炭在空氣中、氧氣中燃燒,比較反應的劇烈程度 D 反應物的性質 分別用酒精燈加熱表面積相同的鎂片和鐵片,比較在空氣中能否被點燃 A.A B.B C.C D.D 發布:2024/12/25 13:0:1組卷:114引用:4難度:0.7


