為了探究原電池和電解池的工作原理,某研究性學(xué)習(xí)小組分別用如圖所示的裝置進行實驗。回答下列問題:
(1)該小組同學(xué)用圖1、圖2裝置進行第一組實驗,圖1是在金屬鋅板上貼上一張用某溶液浸濕的濾紙,圖2是熔融碳酸鹽燃料電池。

①圖2電池負(fù)極區(qū)的電極反應(yīng)為 CO-2e-+CO32-=2CO2CO-2e-+CO32-=2CO2。
②若用硫酸鈉和酚酞的混合溶液浸濕濾紙,用導(dǎo)線將a、b直接相連,則濾紙出現(xiàn) 紅紅色,與鉛筆接觸芯接觸的c位置的電極反應(yīng)式為 O2+4e-+2H2O=4OH-O2+4e-+2H2O=4OH-。
③若用淀粉-KI溶液浸濕濾紙,用導(dǎo)線將a、b與A、B電極相連,鉛筆芯c點處出現(xiàn)藍(lán)色,則導(dǎo)線a接的是 AA(填“A”或“B”)電極。
(2)該小組同學(xué)用圖3裝置進行第二組實驗時發(fā)現(xiàn),兩極均有氣體產(chǎn)生,Y極溶液逐漸變成紫紅色。若氫氧化鈉溶液濃度過高,鐵電極區(qū)會產(chǎn)生紅褐色物質(zhì)。查閱資料知,高鐵酸根離子(FeO42-)在溶液中呈紫紅色,Na2FeO4只在強堿性條件下穩(wěn)定。

①電解過程中,X極溶液的pH 增大增大(填“增大”“減小”或“不變”)。
②電解過程中,Y極生成氣體及Y極溶液逐漸變成紫紅色發(fā)生的電極反應(yīng)式分別為 4OH--4e-=O2↑+2H2O4OH--4e-=O2↑+2H2O、Fe-6e-+8OH-=FeO42-+4H2OFe-6e-+8OH-=FeO42-+4H2O。
③c(Na2FeO4)隨初始c(NaOH)的變化如圖4,分析c(Na2FeO4)變化趨勢不同的原因:隨著c(OH-)增大,Na2FeO4穩(wěn)定性增強,且反應(yīng)較快,但c(OH-)過高,F(xiàn)e電極上有氫氧化鐵生成,使Na2FeO4產(chǎn)率反而降低隨著c(OH-)增大,Na2FeO4穩(wěn)定性增強,且反應(yīng)較快,但c(OH-)過高,F(xiàn)e電極上有氫氧化鐵生成,使Na2FeO4產(chǎn)率反而降低。
【考點】原電池與電解池的綜合.
【答案】CO-2e-+CO32-=2CO2;紅;O2+4e-+2H2O=4OH-;A;增大;4OH--4e-=O2↑+2H2O;Fe-6e-+8OH-=FeO42-+4H2O;隨著c(OH-)增大,Na2FeO4穩(wěn)定性增強,且反應(yīng)較快,但c(OH-)過高,F(xiàn)e電極上有氫氧化鐵生成,使Na2FeO4產(chǎn)率反而降低
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:20引用:2難度:0.5
相似題
-
1.關(guān)于如圖所示的原電池,下列說法正確的是( )

A.石墨電極上發(fā)生氧化反應(yīng) B.電子由鋅片通過導(dǎo)線流向石墨棒 C.該裝置將電能轉(zhuǎn)化為化學(xué)能 D.將稀硫酸換成乙醇,燈泡亮度不變 發(fā)布:2025/1/6 6:0:5組卷:85引用:6難度:0.8 -
2.某原電池結(jié)構(gòu)如圖所示,下列有關(guān)該原電池的說法正確的是( )

A.銅棒為負(fù)極 B.鋅棒發(fā)生還原反應(yīng) C.電子從銅棒經(jīng)外電路流向鋅棒 D.鋅棒質(zhì)量減輕 發(fā)布:2025/1/6 6:0:5組卷:417引用:11難度:0.9 -
3.一種新型短路膜電化學(xué)電池消除CO2裝置如圖所示。下列說法錯誤的是( )
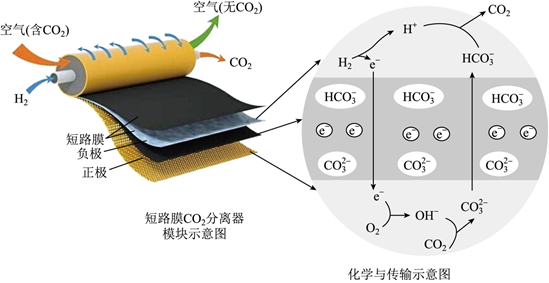
A.負(fù)極反應(yīng)為:H2+2OH--2e-=2H2O B.正極反應(yīng)消耗標(biāo)準(zhǔn)狀況下22.4LO2,理論上需要轉(zhuǎn)移4mol電子 C.短路膜和常見的離子交換膜不同,它既能傳遞離子,還可以傳遞電子 D.該裝置可用于空氣中CO2的捕獲,緩解溫室效應(yīng) 發(fā)布:2024/12/30 19:30:2組卷:51引用:5難度:0.5


