2021-2022學年河北省九校聯考高二(上)期中化學試卷
發布:2024/11/25 0:0:2
一、選擇題(本題共9小題,每小題3分,共27分。在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.下列反應中,△H<0且是氧化還原反應的是( )
A.生石灰與水的反應 B.C與CO2在高溫下的反應 C.KOH與鹽酸的反應 D.碳與濃硫酸的反應 組卷:2引用:2難度:0.7 -
2.100mL3mol?L-1硫酸溶液與過量鋅粉反應,在一定溫度下,為了減緩反應進行的速率,又不影響生成氫氣的總量,可向反應物中加入適量的( )
A.Na2CO3固體 B.蒸餾水 C.NaNO3溶液 D.1mol?L-1的硫酸溶液 組卷:22引用:3難度:0.7 -
3.下列說法正確的是( )
A.一個化學反應,不論是一步完成,還是分幾步完成,其總的熱效應相同 B.等質量的甲烷分別在足量的純氧、空氣中完全燃燒,前者放出的熱量更多 C.H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1,則稀H2SO4和稀Ba(OH)2溶液反應生成1mol水的反應熱為-57.3kJ?mol-1 D.C(s)+H2O(g)═CO(g)+H2(g)ΔH>0,屬于氧化還原反應,可設計成原電池 組卷:8引用:2難度:0.5 -
4.下列事實一定能說明HClO是弱電解質的是( )
A.25℃時,用pH試紙測0.01mol?L-1的HClO溶液的pH為4 B.HClO水溶液中含有HClO分子和H+、ClO- C.10mL0.01mol?L-1 HClO溶液恰好與10mL0.01mol?L-1NaOH溶液完全反應 D.次氯酸不穩定,在光照條件下易分解 組卷:19引用:3難度:0.8 -
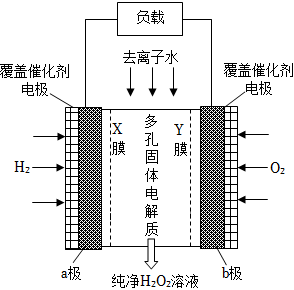 5.《Science》雜志報道了王浩天教授團隊發明的制取H2O2的綠色方法,原理如圖所示(已知:H2O2?H++HO2-,Ka=2.4×10-12)下列說法正確的是( )
5.《Science》雜志報道了王浩天教授團隊發明的制取H2O2的綠色方法,原理如圖所示(已知:H2O2?H++HO2-,Ka=2.4×10-12)下列說法正確的是( )A.Y膜為陽離子交換膜 B.每消耗1mol O2外電路通過4mol e- C.a極電極反應式:H2-2e-═2H+ D.b極電極反應式:O2+4H++4e-═2H2O 組卷:32引用:2難度:0.7 -
6.N2O是一種溫室氣體,且易形成顆粒性污染物,研究N2O的分解對環境保護有重要意義。
途徑Ⅰ:2N2O(g)═2N2(g)+O2(g)
途徑Ⅱ:在N2O中加入少量碘蒸氣
①I2(g)═2I(g)(快反應)
②I(g)+N2O(g)═N2(g)+IO(g)(慢反應)
③2IO(g)+2N2O(g)═2N2(g)+2O2(g)+I2(g)(快反應)
下列表述不正確的是( )A.兩途徑消耗等量N2O時,能量變化相同 B.途徑Ⅱ中反應②的活化能比反應③小 C.途徑Ⅱ中N2O的分解速率由反應②決定 D.IO為反應的中間產物 組卷:39引用:2難度:0.9
三、非選擇題(本題包括4小題,共57分)
-
17.為了探究原電池和電解池的工作原理,某研究性學習小組分別用如圖所示的裝置進行實驗。回答下列問題:
(1)該小組同學用圖1、圖2裝置進行第一組實驗,圖1是在金屬鋅板上貼上一張用某溶液浸濕的濾紙,圖2是熔融碳酸鹽燃料電池。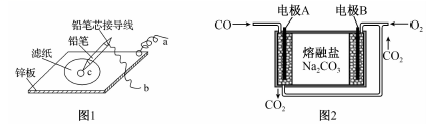
①圖2電池負極區的電極反應為。
②若用硫酸鈉和酚酞的混合溶液浸濕濾紙,用導線將a、b直接相連,則濾紙出現色,與鉛筆接觸芯接觸的c位置的電極反應式為。
③若用淀粉-KI溶液浸濕濾紙,用導線將a、b與A、B電極相連,鉛筆芯c點處出現藍色,則導線a接的是(填“A”或“B”)電極。
(2)該小組同學用圖3裝置進行第二組實驗時發現,兩極均有氣體產生,Y極溶液逐漸變成紫紅色。若氫氧化鈉溶液濃度過高,鐵電極區會產生紅褐色物質。查閱資料知,高鐵酸根離子(FeO42-)在溶液中呈紫紅色,Na2FeO4只在強堿性條件下穩定。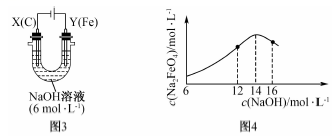
①電解過程中,X極溶液的pH(填“增大”“減小”或“不變”)。
②電解過程中,Y極生成氣體及Y極溶液逐漸變成紫紅色發生的電極反應式分別為、。
③c(Na2FeO4)隨初始c(NaOH)的變化如圖4,分析c(Na2FeO4)變化趨勢不同的原因:。組卷:20引用:2難度:0.5 -
18.汽車尾氣中含有CO、NO等有毒氣體,對汽車加裝尾氣凈化裝置,可使有毒氣體相互反應轉化為無毒氣體。
(1)已知:
①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ?mol-1
v1正=k1正?c(N2)?c(O2),v1逆=k1逆?c2(NO)
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ?mol-1
v2正=k2正?c2(CO)?c(O2),v2逆=k2逆?c2(CO2)
則2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=,請寫出用k1正、k1逆、k2正、k2逆表示該反應在一定溫度下的平衡常數表達式K=。
(2)某實驗小組模擬汽車尾氣CO與NO凈化過程,將CO與NO混合氣體充入密閉容器中,發生反應:2CO(g)+2NO(g)?2CO2(g)+N2(g),測得平衡時NO、CO的轉化率(α)與起始投料比關系如圖1所示,v正~c(CO)的關系如圖2所示。n(CO)n(NO)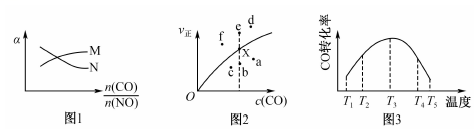
①圖1中CO的轉化率曲線為(填“M”或“N”),圖2中當X點升高到某一溫度時,反應重新達到平衡,則變成相應的點為(填圖2中的字母)。
②一定溫度下,若起始投料比=1、反應開始剛性容器總壓為80kPa,研究表明:該反應的正反應速率v正=1.0×10-3?p2(NO)?p2(CO)(kPa4?h-1),當反應達到平衡狀態時測得該溫度下p(N2)=10kPa,則p(CO)=n(CO)n(NO)kPa,v正=(kPa4?h-1),該溫度下2CO2(g)+N2(g)?2CO(g)+2NO(g)的化學平衡常數Kp=kPa(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
③為研究溫度對CO轉化率的影響,將一定量的CO與NO置于密閉容器中,保持相同的反應時間,CO轉化率與溫度關系如圖3所示,在T1~T2及T4~T5兩個溫度區間所示的CO轉化率變化趨勢不同,其原因是。組卷:26引用:2難度:0.6


