 某課外興趣小組欲測定某鹽酸溶液的濃度,其操作步驟如下:
某課外興趣小組欲測定某鹽酸溶液的濃度,其操作步驟如下:
①將酸式滴定管用蒸餾水洗凈,用待測溶液潤洗后,再注入待測溶液,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0”刻度以下的位置,記下讀數;將錐形瓶用蒸餾水洗凈后,用待測溶液潤洗錐形瓶2~3次;從酸式滴定管中放出25.00mL待測溶液到錐形瓶中。
②將堿式滴定管用蒸餾水洗凈后,立即向其中注入0.1000mol?L-1標準NaOH溶液,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0”刻度以下的位置,記下讀數。
③向錐形瓶中滴入酚酞作指示劑,進行滴定。滴定至終點,測得所耗NaOH溶液的體積為V1mL。
④若按正確操作進行三次實驗,其消耗的NaOH溶液的體積見表:
| 次數 | 1 | 2 | 3 |
| 體積(mL) | 12.48 | 12.52 | 12.04 |
(1)達到滴定終點時的現象為
溶液由無色變為淺紅色,且半分鐘不變
溶液由無色變為淺紅色,且半分鐘不變
;該鹽酸溶液的濃度為 0.0500mol/L
0.0500mol/L
。(2)該小組在步驟①中的錯誤是
錐形瓶進行潤洗
錐形瓶進行潤洗
,由此造成的測定結果 偏高
偏高
。(填“偏高”或“偏低”或“無影響”)(3)如圖是某次滴定時的堿式滴定管中的液面,其讀數為
22.60
22.60
mL。【考點】中和滴定.
【答案】溶液由無色變為淺紅色,且半分鐘不變;0.0500mol/L;錐形瓶進行潤洗;偏高;22.60
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:49引用:6難度:0.4
相似題
-
1.下列實驗方法或操作正確的是( )
A.酸堿中和滴定時,右手旋轉滴定管的活塞,左手搖動錐形瓶,眼睛注視滴定管中的液面 B.用200mL燒杯配制物質的量濃度約為0.1000mol/L氫氧化鈉溶液200mL C.不用另加任何試劑就能鑒別NaAlO2、Na2SiO3、HCl、NaCl四種無色溶液 D.用托盤天平稱取1.6g硫酸銅晶體配制100mL 0.1mol/L的硫酸銅溶液 發布:2024/12/12 8:0:1組卷:9引用:1難度:0.7 -
2.下面關于中和滴定的實驗操作敘述不正確的有( )
①將錐形瓶用蒸餾水和待測定的鹽酸溶液進行洗滌
②取20mL待測定的鹽酸溶液,注入錐形瓶中
③向錐形瓶中加入幾滴酚酞試液為指示劑
④堿式滴定管用蒸餾水洗滌后,直接注入已知濃度的NaOH溶液
⑤進行中和滴定時,一旦錐形瓶內溶液由無色變成粉紅色,即可停止滴定
⑥記錄數據,進行必要的數據處理和得出結論A.①④⑥ B.①②④ C.①②④⑤ D.②③⑤ 發布:2024/12/10 0:30:1組卷:92引用:2難度:0.7 -
3.食醋是日常飲食中的一種調味劑,國家標準規定釀造食醋中醋酸含量不得低于0.035g/mL,實驗室用標準NaOH溶液測定食醋中醋酸的濃度,以檢測食醋是否符合國家標準,某品牌白醋的醋酸濃度測定過程如圖所示,請回答:
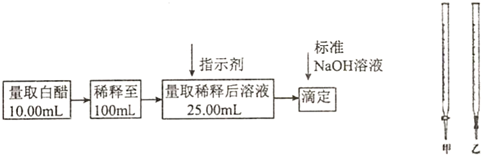
(1)選用上述(填“甲”或“乙”)滴定管量取10.00mL白醋后,將白醋稀釋至100mL時,需要使用的玻璃儀器有燒杯、玻璃棒和.
(2)某同學用酸堿中和滴定法測定該品牌白醋的醋酸濃度,當醋酸與氫氧化鈉恰好完全反應時,測得溶液中=c(CH3COOH)c(CH3COO-),則此時溶液中的pH=11.8×103.(已知:室溫下醋酸的Ka=1.8×10-5)
(3)根據該同學的計算結果,應該選作指示劑.(填“酚酞”、“甲基橙”或“石蕊”)
(4)該滴定達到終點時的現象是.
(5)某次實驗滴定開始和結束時,堿式滴定管中的液面如下圖所示,則所用NaOH溶液的體積為mL.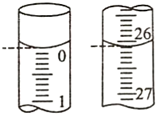
(6)用標準的0.06000mol?L-1NaOH溶液滴定上述稀釋后的醋酸溶液,滴定結果如下表所示:
則該品牌白醋中醋酸含量為滴定次數 待測溶液的體積/mL 標準溶液的體積 滴定前刻度/mL 滴定后刻度/mL 1 25.00mL 0.02 25.01 2 25.00mL 0.70 25.71 3 25.00mL 0.50 24.2 mg/mL.
(7)下列操作中,可能使所測白醋中醋酸的濃度數值偏高的是.(填編號)
A.取待測液的滴管,取液前滴定管尖嘴處無氣泡,取液后尖嘴處出現氣泡
B.滴定前盛放白醋稀溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.堿式滴定管未用標準NaOH溶液潤洗就直接注入標準NaOH溶液
D.讀取NaOH溶液體積時,開始時俯視讀數,滴定結束時仰視讀數
(8)有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度處,現把管內液體全部放出,用量筒接收,得到溶液的體積是.
A.等于10mL
B.等于40mL
C.大于40mL
D.不能確定發布:2024/12/30 3:0:4組卷:54引用:2難度:0.6


