2021-2022學年陜西省寶雞市渭濱區高二(上)期末化學試卷
發布:2025/1/2 16:0:3
一、選擇題(每小題只有一個正確答案,每小題2分,共50分)
-
1.下列說法不正確的是( )
A.能發生有效碰撞的分子稱為活化分子 B.活化分子的平均能量與所有分子的平均能量之差稱為活化能 C.升高溫度,活化分子百分數增大 D.活化分子的總數越多,反應速率越快 組卷:112引用:2難度:0.8 -
2.如圖所示,下列有關化學反應和能量變化的說法正確的是( )

A.圖a可以表示碳酸鈣分解反應的能量變化 B.圖a表示的反應不需要加熱就能發生,圖b表示的反應一定需要加熱才能發生 C.圖b可以表示氯化銨固體與氫氧化鋇晶體反應的能量變化 D.若反應過程A(g)+B(g)?C(g)可以用圖b來表示,則A一定比C穩定 組卷:33引用:2難度:0.7 -
3.化學與能源息息相關。下列說法錯誤的是( )
A.煤的干餾和石油的裂化都屬于化學變化 B.風能、電能、地熱能等都屬于一次能源 C.推廣新能源汽車有助于減少NOx的產生 D.光合作用是將太陽能轉變為化學能的過程 組卷:11引用:1難度:0.7 -
4.對于可逆反應A(g)+3B(s)?2C(g)+2D(g),在不同條件下的化學反應速率如下,其中表示的反應速率最快的是( )
A.v(A)=0.3mol?L-1?s-1 B.v(B)=1.2mol?L-1?s-1 C.v(D)=0.8mol?L-1?min-1 D.v(C)=0.5mol?L-1?s-1 組卷:27引用:7難度:0.7 -
5.可逆反應aA(s)+bB(g)?cC(g)+dD(g)進行過程中,當其他條件不變時,C的體積分數C%與溫度(T)、壓強(p)的關系如圖所示。下列敘述正確的是( )
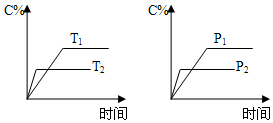
A.達到平衡后,加入催化劑,C的體積分數增大 B.達到平衡后,升高溫度,平衡向逆方向移動 C.化學方程式中,b>c+d D.達到平衡后,增加A的量,平衡向右移動 組卷:103引用:9難度:0.5 -
6.一定條件下:2NO2(g)?N2O4(g)△H<0.在測定NO2的相對分子質量時,下列條件中,測定結果誤差最小的是( )
A.溫度0℃、壓強50kPa B.溫度130℃、壓強300kPa C.溫度25℃、壓強100kPa D.溫度130℃、壓強50kPa 組卷:524引用:34難度:0.6 -
7.一定溫度下,在恒容密閉容器中發生可逆反應:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始濃度分別為0.2mol?L-1、0.6mol?L-1、0.4mol?L-1,當反應達到平衡時,各物質的濃度不可能是( )
A.Z=0.8mol?L-1 B.Y2=0.7mol?L-1 C.X2=0.3mol?L-1 D.Z=0.6mol?L-1 組卷:121引用:2難度:0.4 -
8.在一定條件下,某容器內充入N2和H2合成氨,以下敘述中錯誤的是( )
A.開始反應時,正反應速率最大,逆反應速率為零 B.隨著反應的進行,正反應速率減小,最后降為零 C.隨著反應的進行,正反應速率減小,逆反應速率增大,最后相等 D.在反應過程中,正反應速率的減小等于逆反應速率的增加 組卷:11引用:3難度:0.7 -
9.將amol N2和3amol H2充入絕熱的固定容積密閉容器中,發生合成氨反應N2(g)+3H2(g)?2NH3(g)。下列選項中說明反應已經達到平衡狀態的是( )
①體系的溫度不再改變;
②體系的壓強不再改變;
③混合氣體密度不再改變;
④混合氣體的平均摩爾質量不再改變;
⑤N2和H2的濃度之比達到1:3;
⑥v(N2)正反應=3v(H2)逆反應;
⑦2v(H2)正反應=3v(NH3)逆反應;
⑧每有一根N≡N鍵斷裂就有6molN-H鍵形成。A.②④⑤⑥ B.②④⑥⑧ C.①②④⑥ D.①②④⑦ 組卷:204引用:7難度:0.7 -
10.對于反應2H2O2(aq)?2H2O(l)+O2(g)ΔH,在任何溫度下可自發進行的原因是( )
A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0 C.ΔH<0,ΔS>0 D.ΔH>0,ΔS>0 組卷:35引用:3難度:0.8
二、填空題
-
29.已知常溫下部分弱電解質的電離平衡常數如表:
(1)常溫下,物質的量溶度相同的三種物質的量濃度①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的順序是化學式 HF HClO H2CO3 NH3?H2O 電離常數 6.8×10-4 4.7×10-8 K1=4.3×10-7
K2=5.6×10-11Kb=1.7×10-5 (填序號)。
(2)25℃時,pH=4的NH4Cl溶液中各離子濃度的大小關系為。
(3)NaClO溶液中的電荷守恒關系為。
(4)向NaClO溶液中通入少量的CO2,所發生的離子方程式為。
(5)25℃下,將pH=11的苛性鈉溶液V1L與pH=1的稀硫酸V2L混合(設混合后溶液的體積為原兩溶液體積之和),所得混合溶液的pH=2,則V1:V2=。
(6)25℃時,H2SO3?HSO3-+H+的電離常數Ka=1.0×10-2,則該溫度下NaHSO3的水解常數Kh=。組卷:14引用:3難度:0.7
三、實驗題
-
 30.某課外興趣小組欲測定某鹽酸溶液的濃度,其操作步驟如下:
30.某課外興趣小組欲測定某鹽酸溶液的濃度,其操作步驟如下:
①將酸式滴定管用蒸餾水洗凈,用待測溶液潤洗后,再注入待測溶液,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0”刻度以下的位置,記下讀數;將錐形瓶用蒸餾水洗凈后,用待測溶液潤洗錐形瓶2~3次;從酸式滴定管中放出25.00mL待測溶液到錐形瓶中。
②將堿式滴定管用蒸餾水洗凈后,立即向其中注入0.1000mol?L-1標準NaOH溶液,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0”刻度以下的位置,記下讀數。
③向錐形瓶中滴入酚酞作指示劑,進行滴定。滴定至終點,測得所耗NaOH溶液的體積為V1mL。
④若按正確操作進行三次實驗,其消耗的NaOH溶液的體積見表:
試回答下列問題:次數 1 2 3 體積(mL) 12.48 12.52 12.04
(1)達到滴定終點時的現象為;該鹽酸溶液的濃度為。
(2)該小組在步驟①中的錯誤是,由此造成的測定結果。(填“偏高”或“偏低”或“無影響”)
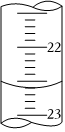
(3)如圖是某次滴定時的堿式滴定管中的液面,其讀數為mL。組卷:49引用:6難度:0.4


