某校化學興趣小組的學生,分成兩組對酸雨及空氣中二氧化硫的含量進行了測試。
Ⅰ.第一組,取剛降到地面的酸雨水樣,進行了如下實驗:
①向雨水試樣中滴加氯化鋇溶液,有白色渾濁出現;
②每隔一段時間測定其pH,數據如下表所示:
| 測定時間/小時 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
Ba2++SO42-=BaSO4↓
Ba2++SO42-=BaSO4↓
。(2)分析上述pH變化數據,你認為可能的原因是(用化學方程式表示)
2SO2+O2+2H2O=2H2SO4或2H2SO3+O2=2H2SO4
2SO2+O2+2H2O=2H2SO4或2H2SO3+O2=2H2SO4
。Ⅱ.第二組,用下列裝置定量分析空氣中SO2的含量:
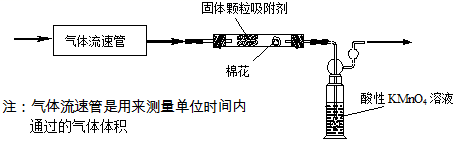
(3)通入空氣前應進行的實驗操作是
氣密性檢驗
氣密性檢驗
。KMnO4溶液中導管末端做成球狀多孔結構的作用是增大接觸面積,有利于二氧化硫被充分吸收
增大接觸面積,有利于二氧化硫被充分吸收
。(4)隨著空氣的不斷通入,酸性KMnO4溶液顏色逐漸變淺直至褪色。已知MnO4-變成Mn2+,SO2變成SO42-,寫出此離子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
,說明SO2具有還原
還原
性。(5)若實驗中氣體流速為aL?min-1、酸性KMnO4溶液的體積bL,其濃度為cmol?L-1,從氣體通入到紫色恰好褪去,用時5min。則此次取樣處的空氣中二氧化硫含量為
32
bc
a
32
bc
a
【考點】二氧化硫的污染及治理.
【答案】Ba2++SO42-=BaSO4↓;2SO2+O2+2H2O=2H2SO4或2H2SO3+O2=2H2SO4;氣密性檢驗;增大接觸面積,有利于二氧化硫被充分吸收;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;還原;
32
bc
a
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:101引用:2難度:0.6
相似題
-
1.利用石灰石和煙氣中的SO2反應生成石膏,可實現煙氣中脫除SO2。某研究性學習小組在實驗室利用如圖所示裝置制備煙氣(主要成分為SO2、CO2、N2、O2),并測定煙氣中SO2的體積分數以及研究煙氣通過轉化器的脫硫效率。請回答下列問題:
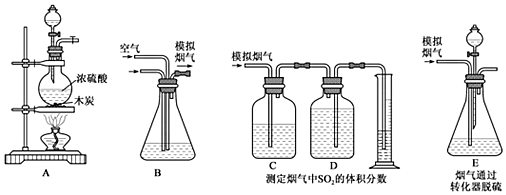
Ⅰ.模擬煙氣的制備。
(1)裝置A中發生反應的化學方程式:。
Ⅱ.測定煙氣中SO2的體積分數。
(2)將A中產生的氣體與空氣一起通過B裝置混合均勻,從而形成模擬煙氣。將部分模擬煙氣緩慢通過C、D裝置,其中C、D中盛有的藥品分別是、。(填序號)
a.KMnO4溶液
b.飽和NaHSO3溶液
c.飽和Na2CO3溶液
d.飽和NaHCO3溶液
裝置C的作用是:。
(3)①甲同學認為測定煙氣中SO2的體積分數的裝置中存在缺陷,你覺得應如何改進。
②乙同學根據模擬煙氣的流速amL?min-1和t1min后測得的量筒內液體的體積VmL,計算煙氣中二氧化硫的體積分數是。
Ⅲ.模擬煙氣通過轉化器的脫硫效率研究。
(4)E中溶液可以催化SO2與O2的反應生成SO42-,以達到脫硫的目的。若模擬煙氣仍以amL?min-1的流速通過轉化器E裝置,t2min后,向E裝置中加入酸化的BaCl2溶液,得到白色渾濁液,經過濾、洗滌、干燥、稱量,得到mg固體。若實驗測得的氣體體積已折算為標準狀況下的體積,則該轉化器的脫硫效率是。發布:2024/12/30 4:30:1組卷:80引用:2難度:0.6 -
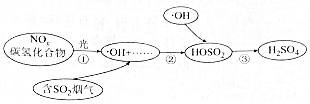 2.研究表明,硫酸型酸雨的形成與空氣中氮的氧化物和碳氫化合物有關,其部分過程如圖所示。下列說法錯誤的是( )
2.研究表明,硫酸型酸雨的形成與空氣中氮的氧化物和碳氫化合物有關,其部分過程如圖所示。下列說法錯誤的是( )A.優化能源結構和減少汽車尾氣排放可減少酸雨的形成 B.1mol?OH中含有10NA個電子(NA為阿伏加德羅常數的值) C.②③中硫元素的化合價均發生改變 D.光能促進酸雨的形成 發布:2024/12/30 7:0:1組卷:3引用:1難度:0.7 -
3.認識含硫物質的性質及轉化規律,能幫助我們更好地認識自然和保護環境。
(1)酸雨的形成原因,將SO2氣體通入蒸餾水中,取出部分溶液并用pH計測定其pH,每隔 10min讀數一次,所得數據如下:
隨著時間的推移,pH逐漸變小的原因是時間(min) 0 10 20 30 40 pH 4.95 4.94 4.86 4.85 4.85 (用化學方程式表示)。
(2)防治SO2對環境的污染。
①從物質分類角度看,SO2屬于酸性氧化物,工業上常用熟石灰將SO2轉化為亞硫酸鹽,寫出所得亞硫酸鹽的化學式:。
②從元素價態看,SO2中S元素為+4價,既具有氧化性,又具有還原性。用生物質熱解氣(主要成分為CO、CH4、H2)可將SO2在高溫下還原成單質硫。寫出CO還原SO2反應的化學方程式:。
(3)獲取空氣質量信息。某化學小組為了測定空氣中SO2的體積分數,做了如下實驗:取標準狀況下的空氣20.00L(含N2、O2、CO2、SO2),緩慢通過足量溴水,反應的化學方程式為:SO2+Br2+H2O→2HBr+H2SO4。在所得溶液中加入稍過量的BaCl2溶液,產生白色沉淀,過濾后將沉淀洗滌、干燥,稱得其質量為4.66g。空氣樣品中SO2的體積分數為。
(4)你認為減少酸雨可采取的措施是(填字母)。①少用煤作燃料②把工廠煙囪造高③化石燃料脫硫④在已酸化的土壤中加生石灰⑤開發新能源
A.①②③
B.②③④⑤
C.①③⑤
D.①③④⑤發布:2024/12/30 5:0:1組卷:62引用:3難度:0.8


