水體中的Cr2O2-7、HCrO-4和CrO2-4是高毒性的重金屬離子,可用Cr(Ⅵ)表示。常用的處理方法是將Cr(Ⅵ)還原為低毒性的Cr3+或Cr(OH)3。
(1)在一定pH的水溶液中,HS-、S2-可與CrO2-4反應(yīng)生成Cr(OH)3和單質(zhì)硫。水溶液中S2-能與單質(zhì)硫反應(yīng)生成S2-n,S2-n能還原Cr(Ⅵ)。
①在pH=9的水溶液中CrO2-4與HS-反應(yīng)的離子方程式為 2CrO2-4+3HS-+5H2O=2Cr(OH)3+3S↓+7OH-2CrO2-4+3HS-+5H2O=2Cr(OH)3+3S↓+7OH-。
②25℃時(shí)用過量S2-還原Cr(Ⅵ),發(fā)現(xiàn)反應(yīng)后期Cr(Ⅵ)被還原的速率反而加快.產(chǎn)生該現(xiàn)象的原因可能是 S2-過量,水溶液中的S2-能與單質(zhì)硫反應(yīng)生成S2-n,S2-n能還原Cr(Ⅵ),所以反應(yīng)后期Cr(Ⅵ)被還原的速率反而加快S2-過量,水溶液中的S2-能與單質(zhì)硫反應(yīng)生成S2-n,S2-n能還原Cr(Ⅵ),所以反應(yīng)后期Cr(Ⅵ)被還原的速率反而加快;驗(yàn)證的實(shí)驗(yàn)方法是 可以在不同的反應(yīng)時(shí)間但相同反應(yīng)時(shí)長的條件下,觀察溶液的褪色程度可以在不同的反應(yīng)時(shí)間但相同反應(yīng)時(shí)長的條件下,觀察溶液的褪色程度。
(2)金屬也可用于還原廢水中的Cr(Ⅵ)。其他條件相同時(shí),用相同物質(zhì)的量的Zn粉、Zn—Cu粉分別處理pH=2.5的含Cr(Ⅵ)廢水,廢水中Cr(Ⅵ)殘留率隨時(shí)間的變化如圖-1所示。圖中b對(duì)應(yīng)的實(shí)驗(yàn)方法處理含Cr(Ⅵ)廢水的效果更好,其原因是 Zn—Cu粉在溶液中形成原電池,加快反應(yīng)速率Zn—Cu粉在溶液中形成原電池,加快反應(yīng)速率。
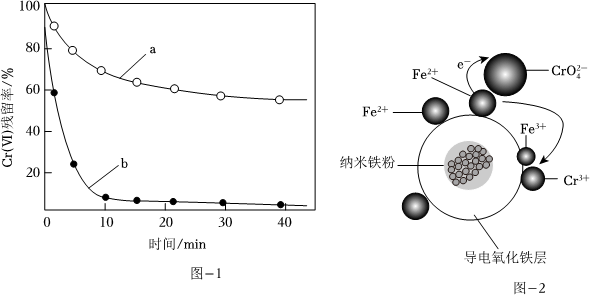
(3)用氧化鐵包裹的納米鐵粉(用Fe/Fe2O3表示)能有效還原水溶液中的Cr(Ⅵ)。Fe/Fe2O3還原近中性廢水中Cr(Ⅵ)的可能反應(yīng)機(jī)理如圖-2所示。Fe/Fe2O3中Fe還原CrO2-4的過程可描述為 單質(zhì)鐵發(fā)生吸氧腐蝕,F(xiàn)e-2e-=Fe2+,3Fe2++CrO2-4+4H2O+4OH-=Cr(OH)3↓+3Fe(OH)3↓單質(zhì)鐵發(fā)生吸氧腐蝕,F(xiàn)e-2e-=Fe2+,3Fe2++CrO2-4+4H2O+4OH-=Cr(OH)3↓+3Fe(OH)3↓。
O
2
-
7
HC
r
O
-
4
C
r
O
2
-
4
C
r
O
2
-
4
S
2
-
n
S
2
-
n
C
r
O
2
-
4
C
r
O
2
-
4
C
r
O
2
-
4
S
2
-
n
S
2
-
n
S
2
-
n
S
2
-
n
C
r
O
2
-
4
C
r
O
2
-
4
C
r
O
2
-
4
【考點(diǎn)】“三廢”處理與環(huán)境保護(hù).
【答案】2+3HS-+5H2O=2Cr(OH)3+3S↓+7OH-;S2-過量,水溶液中的S2-能與單質(zhì)硫反應(yīng)生成,能還原Cr(Ⅵ),所以反應(yīng)后期Cr(Ⅵ)被還原的速率反而加快;可以在不同的反應(yīng)時(shí)間但相同反應(yīng)時(shí)長的條件下,觀察溶液的褪色程度;Zn—Cu粉在溶液中形成原電池,加快反應(yīng)速率;單質(zhì)鐵發(fā)生吸氧腐蝕,F(xiàn)e-2e-=Fe2+,3Fe2+++4H2O+4OH-=Cr(OH)3↓+3Fe(OH)3↓
C
r
O
2
-
4
S
2
-
n
S
2
-
n
C
r
O
2
-
4
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:147引用:2難度:0.6
相似題
-
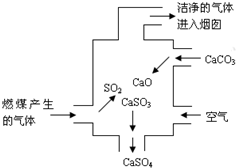 1.右圖是某燃煤發(fā)電廠處理廢氣的裝置示意圖.裝置內(nèi)發(fā)生的主要反應(yīng)中不含( )
1.右圖是某燃煤發(fā)電廠處理廢氣的裝置示意圖.裝置內(nèi)發(fā)生的主要反應(yīng)中不含( )A.化合反應(yīng) B.分解反應(yīng) C.置換反應(yīng) D.氧化還原反應(yīng) 發(fā)布:2024/12/30 4:0:1組卷:331引用:16難度:0.9 -
2.下列說法不正確的是( )
A.酸雨與土壤中的金屬氧化物反應(yīng)后,硫元素以硫酸鹽的形式進(jìn)入土壤中 B.機(jī)動(dòng)車發(fā)動(dòng)機(jī)的燃料燃燒時(shí),高溫條件使空氣中的氮?dú)馀c氧氣反應(yīng),生成氮氧化物 C.節(jié)能不是簡單地減少能源的使用,更重要的是要充分有效地利用能源 D.中國天眼傳輸信息用的光導(dǎo)纖維材料的主要成分是硅 發(fā)布:2024/12/30 5:30:2組卷:27引用:2難度:0.9 -
3.工業(yè)上常用微生物法、吸收法、電解法、還原法等消除硫、氮等引起的污染。
(1)微生物法脫硫
富含有機(jī)物的弱酸性廢水在SBR細(xì)菌作用下產(chǎn)生CH3COOH、H2等物質(zhì),可將廢水中還原為H2S,同時(shí)用N2或CO2將H2S從水中吹出,再用堿液吸收。SO2-4
①的空間構(gòu)型為SO2-4.
②CH3COOH與在SBR細(xì)菌作用下生成CO2和H2S的離子方程式為SO2-4.
③將H2S從水中吹出時(shí),用CO2比N2效果更好,其原因是.
(2)吸收法脫硫
煙氣中的SO2可以用“亞硫酸銨吸收法”處理,發(fā)生的反應(yīng)為(NH4)2SO3+SO2+H2O═2NH4HSO3,測(cè)得25℃時(shí)溶液pH與各組分物質(zhì)的量分?jǐn)?shù)的變化關(guān)系如圖-1所示.b點(diǎn)時(shí)溶液pH=7,則n():n(NH+4)=HSO-3.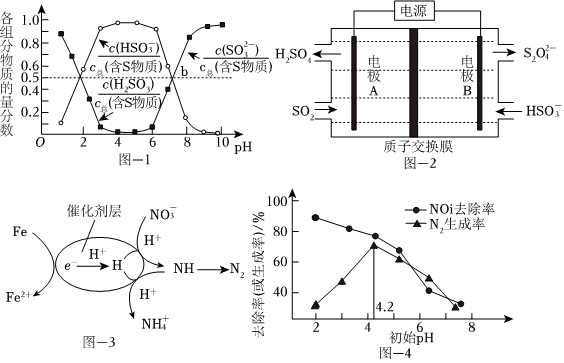
(3)電解法脫硫
用NaOH吸收后SO2,所得NaHSO3溶液經(jīng)電解后可制取Na2S2O4溶液,反應(yīng)裝置如圖-2所示。電解時(shí)每有1molS2生成有O2-4molH+透過質(zhì)子交換膜。
(4)還原法脫氮
用催化劑協(xié)同納米零價(jià)鐵去除水體中。其催化還原反應(yīng)的過程如圖-3所示。NO-3
①該反應(yīng)機(jī)理中生成N2的過程可描述為.
②過程中去除率及N2生成率如圖-4所示,為有效降低水體中氮元素的含量,宜調(diào)整水體pH為4.2,當(dāng)pH<4.2時(shí),隨pH減小,N2生成率逐漸降低的原因是NO-3。發(fā)布:2024/12/30 5:30:2組卷:41引用:4難度:0.5
相關(guān)試卷


