 氨是人科學技術發展史上的一項重大突,目前工業上用氫氣和氨氣直接合成氨。
氨是人科學技術發展史上的一項重大突,目前工業上用氫氣和氨氣直接合成氨。
(1)固氮一直是科學家致力研究的要課題,有關熱力學數據如下:
| 反應 | 大氣固氮N2(g)+O2(g)?2NO(g) | 工業固氮N2(g)+3H2(g)?2NH3(g) | ||||
| 溫度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常數K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
小于
小于
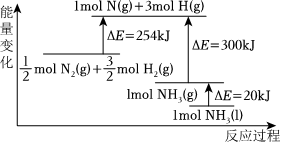
工業固氮(填“大于”或“小于”)。(2)N2(g)與H2(g)反應的能量變化如圖所示,則N2(g)與H2(g)反應制備NH3(g)的熱化學方程式為:
N2(g)+3H2(g)?2NH3(l)ΔH=-132kJ/mol
N2(g)+3H2(g)?2NH3(l)ΔH=-132kJ/mol
。(3)有關工業固氮的說法正確的是
B
B
(選填序號)。A.使用催化劑可提高反應物的轉化率
B.循環使用N2、H2可提高NH3的產率
C.溫度控制在500℃左右有利于反應向正方向進行
D.增大壓強有利于加快反應速率,所以壓強大越好
(4)研究表明某些過渡金屬催化劑可以加速氨氣的分解,某溫度下,用等質量的不同金屬分別催化等濃度的氨氣,測得氨氣分解的初始速率(單位:mmol/min)與催化劑的對應關系如表所示。
| 催化劑 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
Fe
Fe
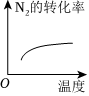
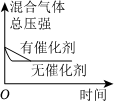
(填化學式)。(5)對于合成氨反應N2(g)+3H2(g)?2NH3(g)ΔH<0,下列研究結果和示意圖相符的是
C
C
。| 選項 | A | B | C | D |
| 研究結果 | 壓強對反應的影響 | 溫度對反應的影響 | 平衡體系增加N2對反應的影響 | 催化劑對反應的影響 |
| 圖示 | 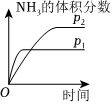 |
 |
 |
 |
【答案】小于;N2(g)+3H2(g)?2NH3(l)ΔH=-132kJ/mol;B;Fe;C
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/10/5 16:0:2組卷:9引用:2難度:0.5
相似題
-
1.下列關于自然界中氮循環的說法不正確的是( )
A.氮元素均被氧化 B.含氮無機物和含氮有機物可相互轉化 C.工業合成氨屬于人工固氮 D.碳、氫、氧三種元素也參與了氮循環 發布:2024/12/30 6:0:2組卷:21引用:9難度:0.8 -
2.自然界中時刻存在著氮的轉化.實現氮按照一定方向轉化一直是科學領域研究的重要課題,如圖為N2分子在催化劑的作用下發生的一系列轉化示意圖。下列敘述正確的是( )
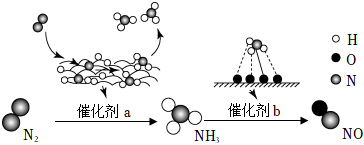
A.N2→NH3,NH3→NO均屬于氮的固定 B.使用催化劑a、b均可以提高單位時間內生成物的產量 C.催化劑a、b表面均發生了極性共價鍵的斷裂 D.在催化劑a作用下,氮原子發生了氧化反應 發布:2024/12/16 14:0:1組卷:202引用:7難度:0.8 -
3.下列過程不屬于固氮的是( )
A.雷電時生成氮的氧化物 B.工業上用氫氣與氮氣合成氨 C.植物的根從土壤中吸收銨鹽 D.根瘤菌把空氣中的氮氣轉化為硝酸鹽 發布:2024/12/30 4:0:1組卷:172引用:6難度:0.9


