2022-2023學年廣東省廣州市從化中學高二(上)期中化學試卷
發布:2024/10/5 16:0:2
一、單項選擇題:本大題包括10小題,每小題2分,共20分。每小題給出的四個選項中,只有一個選項符合題目要求,多選、錯選均不得分。
-
1.下列各組關于強電解質、弱電解質,非電解質的歸類,完全正確的是( )
選項 A B C D 強電解質 Fe NaCl CaCO3 HNO3 弱電解質 CH3COOH NH3 H3PO4 Fe(OH)3 非電解質 蔗糖 BaSO4 酒精 Cl2 A.A B.B C.C D.D 組卷:133引用:11難度:0.8 -
2.下列電離方程式書寫正確的是( )
A.NaHCO3═Na++H++CO32- B.HF?H++F- C.H2SO4?2H++SO42- D.CH3COONH4?CH3COO-+NH4+ 組卷:236引用:8難度:0.7 -
3.已知反應H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ?mol-1,則反應HCl(g)=
H2(g)+12Cl2(g)的△H為( )12A.+184.6 kJ?mol-1 B.-92.3 kJ?mol-1 C.-369.2 kJ?mol-1 D.+92.3 kJ?mol-1 組卷:74引用:60難度:0.9 -
4.可逆反應N2+3H2?2NH3的正、逆反應速率可用各反應物或生成物濃度的變化來表示。下列各關系中能說明反應已達到平衡狀態的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=3v逆(H2) C.v正(N2)=v逆(NH3) D.2v正(H2)=3v逆(NH3) 組卷:37引用:3難度:0.7 -
5.下列事實不能用平衡移動原理解釋的是( )
A.氯水在光照下顏色變淺,最終變為無色 B.夏天打開啤酒瓶,有很多氣泡冒出 C.由NO2(g)、N2O4(g)組成的平衡體系通過縮小體積加壓后顏色變深 D.實驗室用排飽和食鹽水的方法收集Cl2 組卷:31引用:6難度:0.4 -
6.中國首條“生態馬路”在上海復興路隧道建成,它運用了“光觸媒”技術,在路面涂上一種光催化劑涂料,可將汽車尾氣中45%的NO和CO轉化成N2和CO2.下列對此反應的敘述中不正確的是( )
A.使用光催化劑不改變反應物的轉化率 B.該“光觸媒”技術可以杜絕“光化學煙霧”的產生 C.升高溫度能加快反應速率 D.縮小體積,各氣體的濃度都增大 組卷:46引用:3難度:0.7
三、非選擇題(本題包括4個小題,共56分)
-
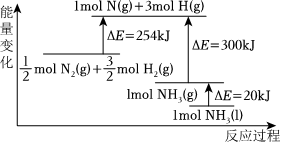 19.氨是人科學技術發展史上的一項重大突,目前工業上用氫氣和氨氣直接合成氨。
19.氨是人科學技術發展史上的一項重大突,目前工業上用氫氣和氨氣直接合成氨。
(1)固氮一直是科學家致力研究的要課題,有關熱力學數據如下:
常溫下,大氣固氮的傾向反應 大氣固氮N2(g)+O2(g)?2NO(g) 工業固氮N2(g)+3H2(g)?2NH3(g) 溫度/℃ 25 2000 25 350 400 450 平衡常數K 3.84×10-31 0.1 5×108 1.847 0.504 0.152 工業固氮(填“大于”或“小于”)。
(2)N2(g)與H2(g)反應的能量變化如圖所示,則N2(g)與H2(g)反應制備NH3(g)的熱化學方程式為:。
(3)有關工業固氮的說法正確的是(選填序號)。
A.使用催化劑可提高反應物的轉化率
B.循環使用N2、H2可提高NH3的產率
C.溫度控制在500℃左右有利于反應向正方向進行
D.增大壓強有利于加快反應速率,所以壓強大越好
(4)研究表明某些過渡金屬催化劑可以加速氨氣的分解,某溫度下,用等質量的不同金屬分別催化等濃度的氨氣,測得氨氣分解的初始速率(單位:mmol/min)與催化劑的對應關系如表所示。
在不同催化劑的催化作用下,氨氣分解反應中的活化能最大的催化劑是催化劑 Fe Pd Ru Rh Pt Ni 初始速率 0.5 1.8 7.9 4.0 2.2 3.0 (填化學式)。
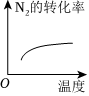
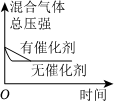
(5)對于合成氨反應N2(g)+3H2(g)?2NH3(g)ΔH<0,下列研究結果和示意圖相符的是。選項 A B C D 研究結果 壓強對反應的影響 溫度對反應的影響 平衡體系增加N2對反應的影響 催化劑對反應的影響 圖示 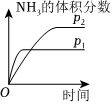

 組卷:9引用:2難度:0.5
組卷:9引用:2難度:0.5 -
20.工業燃燒煤、石油等化石燃料釋放出大量氮氧化物(NOx)、CO2、SO2等氣體,嚴重污染空氣。通過對廢氣進行脫硝、脫碳和脫硫處理可實現綠色環保、廢物利用。
(1)甲醇不僅是重要的化工原料,而且還是性能優良的能源和車用燃料。甲醇和水蒸氣制取H2 的反應如下:
反應Ⅰ(主):CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1 平衡常數為K1
反應Ⅱ(副):H2(g)+CO2(g)?CO(g)+H2O(g)△H2 平衡常數為K2
反應Ⅲ:CH3OH(g)?CO(g)+2H2(g)△H3 平衡常數為K3
反應Ⅰ的△H1=(用△H2、△H3表示),平衡常數K1=(用K2、K3表示)
(2)向2 L密閉容器中加入2molCO2和6molH2,在適當的催化劑作用下,下列反應能自發進行:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)。
①該反應ΔH0(填“>”、“<”或“=”)
②下列敘述能說明此反應達到平衡狀態的是。(填字母)
A.混合氣體的平均相對分子質量保持不變
B.CO2的轉化率和H2的轉化率相等
C.1mol CO2生成的同時有3mol H-H鍵斷裂
D.混合氣體的密度保持不變
③反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在體積相同(2L)的兩密閉容器中,改變條件,反應過程中部分數據見下表:
反應Ⅰ,前10min內的平均反應速率v(H2)=反應時間 CO2/mol H2/mol CH3OH/mol H2O/mol 反應Ⅰ:300K 0 min 2 6 0 0 10 min 4.5 20 min 1 30 min 1 反應Ⅱ:500K 0 min 0 0 2 2 。達到平衡時,反應Ⅰ、Ⅱ對比:平衡常數K(I)K(Ⅱ)(填“>”、“<”或“=”);平衡時CH3OH的濃度c(I)c(Ⅱ)(填“>”、“<”或“=”)。
(3)消除汽車尾氣的反應式之一為:2CO(g)+2NO(g)?N2(g)+2CO2(g)。在溫度T1時,將1.40molCO與1.60molNO充入一體積為2L的密閉容器中,反應平衡后N2的物質的量分數為0.25。求NO的平衡轉化率α1和反應平衡常數K(寫出計算過程)。組卷:2引用:3難度:0.5


