 化學實驗是研究物質變化的重要手段,對于揭示化學反應規律,獲得調控反應的理論依據,以及日常生活和工農業生產都具有重要的意義。
化學實驗是研究物質變化的重要手段,對于揭示化學反應規律,獲得調控反應的理論依據,以及日常生活和工農業生產都具有重要的意義。
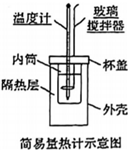
(1)用如圖所示裝置進行中和反應反應熱的測定實驗,請回答下列問題:
| 實驗次數 | 起始溫度t1/℃ | 終止溫 度t2/℃ |
溫度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | ① 3.4 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
-56.8
-56.8
kJ/mol(取小數點后一位)。③上述實驗數值結果與57.3kJ/mol有偏差,產生偏差的原因可能是
abcd
abcd
(填字母)。a.實驗裝置保溫、隔熱效果差
b.量取NaOH溶液的體積時仰視讀數
c.分多次把NaOH溶液倒入盛有硫酸的小燒杯中
d.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度
(2)某化學興趣小組探究濃度對化學反應速率的影響,選擇酸性KMnO4溶液與草酸(H2C2O4)溶液的反應作為研究對象,已知2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O。25℃時,測定溶液褪色所需的時間,依據褪色快慢比較濃度對反應速率的影響,小組同學為此設計出兩種實驗方案。
| 實驗方案 | 酸性KMnO4溶液 | H2C2O4溶液 | 紫紅色溶液褪至無色所需時間t/min | |||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | |||
| 方案一 | ① | 4 | 0.01 | 2 | 0.2 | t1 |
| ② | 4 | 0.02 | 2 | 0.2 | t2 | |
| 方案二 | ③ | 4 | 0.01 | 2 | 0.1 | t3 |
| ④ | 4 | 0.01 | 2 | 0.2 | t4 | |
方案二
方案二
(填“方案一”或“方案二”)可行,理由是 方案一改變酸性高錳酸鉀的濃度,高錳酸鉀的量不同,褪色所需要的時間本身就不相同,變量不唯一
方案一改變酸性高錳酸鉀的濃度,高錳酸鉀的量不同,褪色所需要的時間本身就不相同,變量不唯一
。(3)工業合成氨是人類科學技術的一項重大突破,對國民經濟和社會發展具有重要的意義。已知:N2(g)+3H2(g)?2NH3(g) ΔH=-92.4kJ?mol-1。不同條件下,合成氨反應達到化學平衡時反應混合物中氨的含量(體積分數)如表所示:
| 溫度/℃ | 氨的含量/% | ||||
| 0.1MPa | 10MPa | 20MPa | 30MPa | 60MPa | |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 |
| 300 | 2.20 | 52.0 | 64.2 | 71.0 | 84.2 |
| 400 | 0.40 | 25.1 | 38.2 | 47.0 | 65.2 |
| 500 | 0.10 | 10.6 | 19.1 | 26.4 | 42.2 |
| 600 | 0.05 | 4.50 | 9.10 | 13.8 | 23.1 |
B
B
(填字母)。A.高溫低壓
B.低溫高壓
C.高溫高壓
D.低溫低壓
②實際生產中一般采用的反應條件為400~500℃和10MPa~30MPa,原因可能是
升溫可加快反應速率且400~500℃催化劑活性最好;壓強太大,對動力和生產設備的要求高
升溫可加快反應速率且400~500℃催化劑活性最好;壓強太大,對動力和生產設備的要求高
。【答案】3.4;-56.8;abcd;方案二;方案一改變酸性高錳酸鉀的濃度,高錳酸鉀的量不同,褪色所需要的時間本身就不相同,變量不唯一;B;升溫可加快反應速率且400~500℃催化劑活性最好;壓強太大,對動力和生產設備的要求高
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:5引用:1難度:0.7
相似題
-
1.下列關于中和反應的反應熱測定實驗的說法正確的是( )
A.小燒杯內殘留水,會使測得的反應熱數值偏小 B.酸、堿混合時,應把量筒中的溶液緩緩倒入燒杯的溶液中,以防液體外濺 C.燒杯間填滿碎紙條的作用是固定小燒杯 D.可用相同濃度和體積的氨水代替稀氫氧化鈉溶液進行實驗 發布:2024/12/14 13:30:1組卷:36引用:3難度:0.7 -
 2.中和熱測定實驗中,用50mL0.50mol?L-1鹽酸和50mL0.55mol?L-1NaOH進行實驗,下列說法不正確的是( )
2.中和熱測定實驗中,用50mL0.50mol?L-1鹽酸和50mL0.55mol?L-1NaOH進行實驗,下列說法不正確的是( )A.改用60 mL0.50 mol?L-1鹽酸跟50 mL0.55 mol?L-1NaOH溶液進行反應,求出的中和熱數值和原來相同 B.測定過程中溫度計至少用到3次,測量混合后的溶液溫度時,應記錄反應后的最高溫度 C.酸堿混合時,量筒中NaOH溶液應緩緩倒入小燒杯中,不斷用環形玻璃攪拌棒攪拌 D.裝置中的大小燒杯之間填滿碎泡沫塑料的作用是保溫隔熱、減少熱量損失 發布:2024/12/3 9:0:2組卷:49引用:2難度:0.7 -
3.已知:25℃、101kPa時,H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1。分別使用3組稀溶液來測定中和反應的反應熱,下列說法正確的是( )
序號 ① ② ③ 稀溶液 硫酸和氫氧化鈉 硫酸和氨水 硫酸和氫氧化鋇 ΔH/(kJ?mol-1) a b c A.b<a<c B.生成的水越多,中和反應的反應熱越小 C.酸堿混合要迅速,否則熱量容易散失 D.實驗中的玻璃攪拌器可換成鐵制攪拌器 發布:2024/10/10 0:0:4組卷:34引用:4難度:0.7


