2021-2022學年重慶市萬州二中高二(上)第一次月考化學試卷
發布:2024/11/30 12:0:2
一、選擇題(本大題共14小題,每小題3分,共42分。每小題只有一個選項符合題目要求)
-
1.下列說法正確的是( )
A.活化分子具有的能量叫做活化能 B.活化分子之間發生的碰撞一定為有效碰撞 C.若反應的活化能接近零,當反應物接觸時瞬間完成反應 D.對有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積)或者升高溫度,可增加活化分子的百分數,從而使反應速率增大 組卷:52引用:1難度:0.8 -
2.下列說法正確的是( )
A.焓變是指1mol物質參加反應時的能量變化 B.在一個化學反應中,當反應物總焓小于生成物的總焓時,ΔH為正值 C.濃硫酸溶于水屬于放熱反應 D.需要加熱才能發生的反應一定是吸熱反應 組卷:12引用:1難度:0.7 -
3.在2A(g)+B(g)═3C(g)+4D(g)反應中,下面表示的反應速率最快的是( )
A.v(A)=0.5mol/(L?s) B.v(B)=1.8mol/(L?min) C.v(C)=0.9mol/(L?s) D.v(D)=1.0mol/(L?s) 組卷:117引用:4難度:0.5 -
4.反應Ⅰ:H2(g)+I2(g)?2HI(g)的平衡常數為K1;反應Ⅱ:HI(g)?
H2(g)+12I2(g)的平衡常數為K2,上述反應的平衡常數為同溫度下的測定值,則K1、K2的關系為( )12A.K1=K2 B.K1= K212C.K1= K213D.K1= 1K22組卷:76引用:2難度:0.8 -
5.在密閉容器中進行如下反應:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始濃度分別為0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,在一定條件下,當反應達到平衡時,各物質的濃度有可能是( )
A.Z為0.3 mol?L-1 B.X2為0.2 mol?L-1 C.Y2為0.4 mol?L-1 D.c(X2)+c(Y2)+c(Z)=0.55 mol?L-1 組卷:78引用:7難度:0.9 -
6.下列事實不能用平衡移動原理解釋的是( )
A.重鉻酸鉀溶液中存在:Cr2O72-(橙色)+H2O?2CrO42-(黃色)+2H+,若滴加少量NaOH溶液,溶液由橙色變黃色 B.由H2(g)、I2(g)、H(g)組成的平衡體系通過縮小體積加壓后顏色變深 C.實驗室用排飽和食鹽水的方法收集Cl2 D.將盛有二氧化氮和四氧化二氮混合氣體的密閉容器置于冰水中,混合氣體的顏色變淺 組卷:12引用:2難度:0.6
二、非選擇題(本大題共4小題,共58分)
-
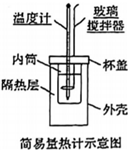 17.化學實驗是研究物質變化的重要手段,對于揭示化學反應規律,獲得調控反應的理論依據,以及日常生活和工農業生產都具有重要的意義。
17.化學實驗是研究物質變化的重要手段,對于揭示化學反應規律,獲得調控反應的理論依據,以及日常生活和工農業生產都具有重要的意義。
(1)用如圖所示裝置進行中和反應反應熱的測定實驗,請回答下列問題:
②近似認為50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比熱容c=4.18J/(g?℃)。則中和熱ΔH=實驗次數 起始溫度t1/℃ 終止溫
度t2/℃溫度差平均值(t2-t1)/℃ H2SO4 NaOH 平均值 1 26.2 26.0 26.1 29.5 ① 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 kJ/mol(取小數點后一位)。
③上述實驗數值結果與57.3kJ/mol有偏差,產生偏差的原因可能是(填字母)。
a.實驗裝置保溫、隔熱效果差
b.量取NaOH溶液的體積時仰視讀數
c.分多次把NaOH溶液倒入盛有硫酸的小燒杯中
d.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度
(2)某化學興趣小組探究濃度對化學反應速率的影響,選擇酸性KMnO4溶液與草酸(H2C2O4)溶液的反應作為研究對象,已知2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O。25℃時,測定溶液褪色所需的時間,依據褪色快慢比較濃度對反應速率的影響,小組同學為此設計出兩種實驗方案。
你認為實驗方案 酸性KMnO4溶液 H2C2O4溶液 紫紅色溶液褪至無色所需時間t/min V/mL c/(mol?L-1) V/mL c/(mol?L-1) 方案一 ① 4 0.01 2 0.2 t1 ② 4 0.02 2 0.2 t2 方案二 ③ 4 0.01 2 0.1 t3 ④ 4 0.01 2 0.2 t4 (填“方案一”或“方案二”)可行,理由是。
(3)工業合成氨是人類科學技術的一項重大突破,對國民經濟和社會發展具有重要的意義。已知:N2(g)+3H2(g)?2NH3(g) ΔH=-92.4kJ?mol-1。不同條件下,合成氨反應達到化學平衡時反應混合物中氨的含量(體積分數)如表所示:
①為了提高平衡混合物中氨的含量,根據化學平衡移動原理,僅從理論上分析合成氨適宜的條件是溫度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 200 15.3 81.5 86.4 89.9 95.4 300 2.20 52.0 64.2 71.0 84.2 400 0.40 25.1 38.2 47.0 65.2 500 0.10 10.6 19.1 26.4 42.2 600 0.05 4.50 9.10 13.8 23.1 (填字母)。
A.高溫低壓
B.低溫高壓
C.高溫高壓
D.低溫低壓
②實際生產中一般采用的反應條件為400~500℃和10MPa~30MPa,原因可能是。組卷:5引用:1難度:0.7 -
18.溫室氣體減排是全世界關注的熱點問題。CH4-CO2的催化重整不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
(1)CH4-CO2催化重整反應為:CH4(g)+CO2(g)?2CO(g)+2H2(g)。
已知:
C(s)+2H2(g)?CH4(g) ΔH=-75kJ?mol-1
C(s)+O2(g)═CO2(g) ΔH=-394kJ?mol-1
C(s)+O2(g)═CO(g) ΔH=-111kJ?mol-112
2H2(g)+O2(g)═2H2O(1)ΔH=-571.6kJ?mol-1
①該催化重整反應的ΔH=kJ?mol-1。
②在25℃、101kPa條件下,如果相同質量的一氧化碳、氫氣分別完全燃燒時,(填化學式)放出的熱量多。
(2)在一定條件下的密閉容器中,當投料比=1時,發生催化重整反應。n(CO2)n(CH4)
①能說明反應CH4(g)+CO2(g)?2CO(g)+2H2(g)達到平衡狀態的有(填字母)。
A.保持不變c(CO)c(H2)
B.絕熱體系中,體系的溫度保持不變
C.H2的體積分數保持不變
D.2v(CH4)=v(H2)
E.恒溫恒壓條件下,混合氣體的平均相對分子質量不再改變
F.恒溫恒容條件下,混合氣體的密度保持不變
②上述反應達到平衡后,若保持溫度和壓強不變,通入氦氣,平衡(填“不”“正向”或“逆向”)移動,CO的濃度(填“增大”“減小”或“不變”)。
③在恒溫恒壓下,平衡時CH4的體積分數為10%,則CH4的轉化率為%(保留一位小數),若總壓強用P表示,則該條件下壓強平衡常數Kp。(用平衡分壓代替平衡濃度計算,氣體分壓=氣體總壓×物質的量分數,不考慮有關量的單位)組卷:18引用:1難度:0.4


