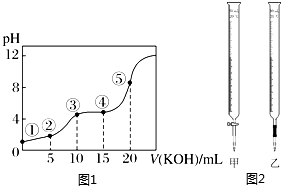
 室溫下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4(二元弱酸)溶液所得滴定曲線如圖1,請回答下列問題:
室溫下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4(二元弱酸)溶液所得滴定曲線如圖1,請回答下列問題:
(1)用電離方程式表示草酸溶液顯酸性的原因H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-。
(2)點⑤所示溶液中,[OH-]-[H+]>>[H2C2O4]+[HC2O4-]。(填“>”、“<”“=”)
(3)已知:KMnO4、MnO2在酸性條件下均能將草酸鈉(Na2C2O4)氧化成CO2,測定軟錳礦中MnO2質量分數(shù)的方法是:稱取1.20g軟錳礦樣品,加入2.68g草酸鈉固體,再加入足量的稀硫酸并加熱(雜質不參加反應),充分反應后冷卻,濾去雜質,將所得濾液轉移到250mL容量瓶中并定容,從中取出25.00mL待測液放入錐形瓶中,再用0.0200mol/L KMnO4標準溶液進行滴定,反應的離子方程式為:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O,當?shù)稳?0.00mL KMnO4溶液時恰好完全反應。
①在酸性條件下,MnO2將Na2C2O4氧化的離子方程式為MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2OMnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O。
②0.0200mol/L KMnO4標準溶液應選用如圖2中的甲甲(填“甲”或“乙”)盛裝。
③將錐形瓶置于滴定管下方進行滴定時,眼睛注視錐形瓶中溶液顏色變化錐形瓶中溶液顏色變化直至滴定終點;判斷到達滴定終點的現(xiàn)象是錐形瓶中溶液恰好由無色變成紫紅色,且30秒內(nèi)不褪色錐形瓶中溶液恰好由無色變成紫紅色,且30秒內(nèi)不褪色。
④軟錳礦中MnO2的質量分數(shù)為72.5%72.5%。
【考點】酸堿混合時的定性判斷及有關pH的計算;中和滴定.
【答案】H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-;>;MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O;甲;錐形瓶中溶液顏色變化;錐形瓶中溶液恰好由無色變成紫紅色,且30秒內(nèi)不褪色;72.5%
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:37引用:1難度:0.6
相似題
-
1.常溫下,在體積均為20mL、濃度均為0.1mol/L的HX溶液、HY溶液中分別滴加0.1mol/L的NaOH溶液,反應后溶液中水電離的c(H+)的負對數(shù)[-lgc(H+)水]與滴加氫氧化鈉溶液體積的關系如圖所示。下列推斷正確的是( )
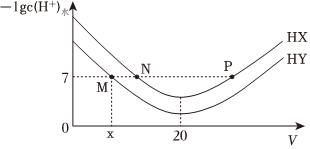
A.HX、HY均為弱酸且HX>HY B.P點溶液中c(Na+ )=c(X-)>c(H+)=c(OH-) C.常溫下用蒸餾水分別稀釋N、P點溶液,溶液pH都變小 D.常溫下,HY的電離常數(shù)Ka= x(20-x)×10-7發(fā)布:2024/12/15 2:30:7組卷:71引用:4難度:0.6 -
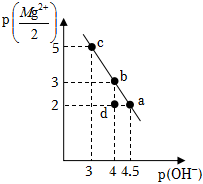 2.25℃時,向10mL0.05mol?L-1的MgCl2溶液中通入氨氣,測得溶液中的p(OH-)與p()之間的變化曲線如圖所示[已知:Kb(NH3?H2O)=1.0×10-5,p(X)=-lgc(X),忽略反應過程中溶液體積的變化]。下列說法正確的是( )Mg2+2
2.25℃時,向10mL0.05mol?L-1的MgCl2溶液中通入氨氣,測得溶液中的p(OH-)與p()之間的變化曲線如圖所示[已知:Kb(NH3?H2O)=1.0×10-5,p(X)=-lgc(X),忽略反應過程中溶液體積的變化]。下列說法正確的是( )Mg2+2A.a(chǎn)點溶液滿足:2c(Mg2+)+c( )<c(Cl-)NH+4B.b點溶液滿足:c( )>c(Cl-)>c(Mg2+)>c(OH-)NH+4C.c點溶液中通入NH3的量在標準狀況下的體積為22.4mL D.d點溶液中無Mg(OH)2沉淀產(chǎn)生 發(fā)布:2024/12/30 4:0:1組卷:23引用:2難度:0.5 -
3.下列說法正確的是( )
A.食鹽溶液中除去SO42- 最合適的試劑是Ba(NO3)2 B.NaCl溶液和CH3COONH4溶液均顯中性,兩溶液中水的電離程度相同 C.25℃時,用醋酸溶液中和等濃度NaOH溶液至pH=7,VCH3COOH<VNaOH D.AgCl易轉化為AgI沉淀且Ksp(AgX)=[Ag+]?[X-],故Ksp(AgI)<Ksp(AgCl) 發(fā)布:2025/1/1 8:0:2組卷:0引用:1難度:0.7


