2020-2021學年廣東省惠州市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共計20分。在每小題列出的四個選項中,只有一項是最符合題目要求的。
-
1.港珠澳大橋的建造使用了大量鋼材.對鋼鐵采取的防腐措施合理的是( )
A.表面鑲銅 B.表面噴涂油漆 C.用水清洗 D.增加鋼鐵中的碳含量 組卷:68引用:7難度:0.9 -
2.下列有關能量的說法不正確的是( )
A.化學能可轉變為電能 B.化學反應伴隨能量變化是化學反應基本特征之一 C.化學反應能量轉換遵守能量守恒定律 D.化學變化時斷裂化學鍵需放出能量 組卷:51引用:1難度:0.8 -
3.某自熱飯盒的熱能來源于水和生石灰的反應。下列說法正確的是( )
A.該反應為氧化還原反應 B.該過程中化學能轉化為熱能 C.熱能也可由NH4NO3溶于水來提供 D.該反應生成物總能量高于反應物總能量 組卷:110引用:6難度:0.9 -
4.金屬Zn與酸反應產生H2的反應速率最大的是( )
選項 溫度 金屬 酸 A 25℃ Zn粒 0.1mol?L-1鹽酸 B 25℃ Zn粒 0.1mol?L-1硫酸 C 50℃ Zn粉 0.1mol?L-1硫酸 D 50℃ Zn粉 0.1mol?L-1鹽酸 A.A B.B C.C D.D 組卷:42引用:2難度:0.7 -
5.氫氰酸(HCN)的下列性質中,不能說明它是弱電解質的是( )
A.1mol?L-1氫氰酸溶液的pH約為3 B.同濃度的鹽酸比HCN溶液導電性強 C.同濃度同體積的HCN溶液和NaOH溶液混合,溶液呈堿性 D.10mL 1mol?L-1HCN恰好與10mL 1mol?L-1NaOH溶液完全反應 組卷:38引用:3難度:0.7 -
6.下列事實不能用勒夏特列原理解釋的是( )
A.陰暗處密封有利于氯水的儲存 B.酯化反應中,用過量乙醇提高乙酸轉化率 C.合成氨工業中使用鐵觸媒作催化劑 D.熱的純堿溶液比冷的純堿溶液洗滌油污效果更好 組卷:15引用:1難度:0.7
三、非選擇題(共52分)
-
19.將H2S轉化為可再利用的資源是能源研究領域的重要課題。
(1)H2S的轉化
①反應Ⅰ的化學方程式是Ⅰ 克勞斯法 H2S SO2Ⅱ 鐵鹽氧化法 H2S SFe3+Ⅲ 光分解法 H2S H2+S光某溶液。
②反應Ⅱ:+1H2S═Fe2++S↓+(將反應補充完整)。
③反應Ⅲ體現了H2S的穩定性弱于H2O.結合原子結構解釋二者穩定性差異的原因:。
(2)反應Ⅲ硫的產率低,反應Ⅱ的原子利用率低。我國科研人員設想將兩個反應耦合,實現由H2S高效產生S和H2,電子轉移過程如圖。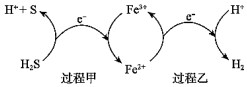
過程甲、乙中,氧化劑分別是。
(3)按照設計,科研人員研究如下。
①首先研究過程乙是否可行,裝置如圖。經檢驗,n極區產生了Fe3+,p極產生了H2.n極區產生Fe3+的可能原因: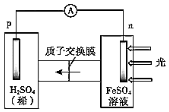
ⅰ.Fe2+-e-=Fe3+
ⅱ.2H2O-4e-=O2 +4H+,(寫離子方程式)。
經確認,ⅰ是產生Fe3+的原因。過程乙可行。
②光照產生Fe3+后,向n極區注入H2S溶液,有S生成,持續產生電流,p極產生H2.研究S產生的原因,設計如下實驗方案:。 經確認,S是由Fe3+氧化H2S所得,H2S不能直接放電。過程甲可行。
(4)綜上,反應Ⅱ、Ⅲ能耦合,同時能高效產生H2和S,其工作原理如圖。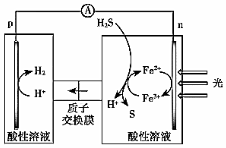
進一步研究發現,除了Fe3+/Fe2+外,I3-/I-也能實現如圖所示循環過程。結合化學用語,說明I3-/I-能夠使S源源不斷產生的原因:。組卷:76引用:3難度:0.6 -
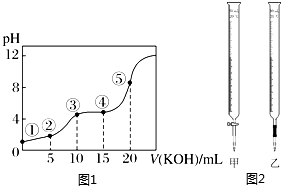 20.室溫下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4(二元弱酸)溶液所得滴定曲線如圖1,請回答下列問題:
20.室溫下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4(二元弱酸)溶液所得滴定曲線如圖1,請回答下列問題:
(1)用電離方程式表示草酸溶液顯酸性的原因。
(2)點⑤所示溶液中,[OH-]-[H+][H2C2O4]+[HC2O4-]。(填“>”、“<”“=”)
(3)已知:KMnO4、MnO2在酸性條件下均能將草酸鈉(Na2C2O4)氧化成CO2,測定軟錳礦中MnO2質量分數的方法是:稱取1.20g軟錳礦樣品,加入2.68g草酸鈉固體,再加入足量的稀硫酸并加熱(雜質不參加反應),充分反應后冷卻,濾去雜質,將所得濾液轉移到250mL容量瓶中并定容,從中取出25.00mL待測液放入錐形瓶中,再用0.0200mol/L KMnO4標準溶液進行滴定,反應的離子方程式為:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O,當滴入20.00mL KMnO4溶液時恰好完全反應。
①在酸性條件下,MnO2將Na2C2O4氧化的離子方程式為。
②0.0200mol/L KMnO4標準溶液應選用如圖2中的(填“甲”或“乙”)盛裝。
③將錐形瓶置于滴定管下方進行滴定時,眼睛注視直至滴定終點;判斷到達滴定終點的現象是。
④軟錳礦中MnO2的質量分數為。組卷:37引用:1難度:0.6


