Ⅰ.(1)H2S溶于水的電離方程式為 H2S?H++HS-H2S?H++HS-。
(2)向H2S溶液中加入Na2S固體時,電離平衡向 左左 (填“左”或“右”)移動,c(H+) 減小減小(填“增大”“減小”或“不變”,下同),電離常數Ka2不變不變。
Ⅱ.電離度可表示電解質的相對強弱,電離度a=已電離的電解質的濃度溶液中原有電解質的濃度×100%。已知259℃時幾種物質(微粒)的電離度(溶液濃度均為0.1mol?L-1)如表所示:
已電離的電解質的濃度
溶液中原有電解質的濃度
| 編號 | 物質(微粒) | 電離度α |
| A | 硫酸溶液(第一步完全電離):第二步HSO4-?SO42-+H+ | 10% |
| B | 硫酸氫鈉溶液:HSO4-?SO42-+H+ | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 鹽酸:HCl═H++Cl- | 100% |
D>A>B>C
D>A>B>C
(填序號)。(2)25℃時,0.1mol?L-1硫酸溶液中HSO4-的電離度小于相同溫度下0.1mol?L-1硫酸氫鈉溶液中HSO4-的電離度,其原因是
硫酸的第一步電離抑制了硫酸氫根離子的電離
硫酸的第一步電離抑制了硫酸氫根離子的電離
。(3)物質的量濃度為cmol?L-1的醋酸的電離平衡常數Ka與電離度a的關系為
c
α
2
1
-
α
c
α
2
1
-
α
【答案】H2S?H++HS-;左;減小;不變;D>A>B>C;硫酸的第一步電離抑制了硫酸氫根離子的電離;
c
α
2
1
-
α
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:17引用:3難度:0.6
相似題
-
1.下列有關化學用語使用正確的是( )
A.碳酸氫鈉在水中的電離方程式:NaHCO3=Na++H++CO32- B.Cl-的結構示意圖: 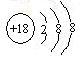
C.H2的摩爾質量是2g D.NaOH俗稱燒堿 發布:2025/1/3 8:0:1組卷:17引用:1難度:0.8 -
2.下列說法正確的是( )
A.固態共價化合物不導電,但熔融態的共價化合物可以導電 B.氨溶于水得到的氨水能導電,所以氨水是電解質 C.硫酸氫鈉在熔融狀態下的電離方程式為 NaHSO4═Na++H++SO42- D.某金屬元素R由化合態變為游離態,R定被還原 發布:2024/12/31 8:0:1組卷:23引用:1難度:0.8 -
 3.次磷酸鈉(NaH2PO2)屬于正鹽,次磷酸根的球棍模型如圖所示,下列說法錯誤的是( )(H2PO-2)
3.次磷酸鈉(NaH2PO2)屬于正鹽,次磷酸根的球棍模型如圖所示,下列說法錯誤的是( )(H2PO-2)A.P的原子結構示意圖為: 
B.次磷酸根P的化合價為+1 C.次磷酸鈉(NaH2PO2)的電離方程式為:NaH2PO2=Na++2H++ P3-2D.紅磷和白磷,O2和O3互為同素異形體 發布:2024/12/12 8:0:1組卷:39引用:4難度:0.5


