2022-2023學年遼寧省沈陽市郊聯體高二(上)月考化學試卷(10月份)
發布:2024/11/27 13:0:2
一、選擇題(共15小題,每小題3分,滿分45分)
-
1.在下列四支試管中發生反應:Fe+H2SO4=FeSO4+H2↑,生成氫氣速率最大的是( )
試管 等質量鐵的形狀 溫度/℃ 硫酸濃度/mol?L-1 A 鐵片 25 18.4 B 鐵片 35 0.5 C 鐵片 35 1 D 鐵粉 35 1 A.A B.B C.C D.D 組卷:10引用:1難度:0.6 -
2.日常生活中的下列做法,與調控反應速率無關的是( )
A.食品制成真空包裝 B.在鐵制品表面刷油漆 C.向鎖芯里加入少量鉛筆芯粉末 D.用冰箱冷藏食物 組卷:209引用:3難度:0.8 -
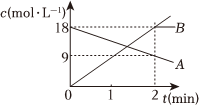 3.反應:A═2B中,A、B的濃度變化如圖所示.則2min以內的平均反應的速率為( )
3.反應:A═2B中,A、B的濃度變化如圖所示.則2min以內的平均反應的速率為( )A.vA=9 mol/(L?min) B.vA=4.5 mol?L?min C.vB=18 mol/(L?min) D.vB=9mol/(L?min) 組卷:113引用:9難度:0.9 -
4.在四個不同的容器中,在不同的條件下進行合成氨的反應,根據下列在相同時間內測定的結果判斷,化學反應速率最快的是( )
A.v (H2)=0.2mol?L-1?min-1 B.v (H2)=0.04mol?L-1?s-1 C.v (N2)=0.01mol?L-1?s-1 D.v (N2)=0.2mol?L-1?min-1 組卷:16引用:1難度:0.7 -
5.下列說法正確的是( )
A.增大反應物濃度可增大單位體積內活化分子的百分數,從而使有效碰撞次數增多 B.有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加活化分子的百分數,從而使反應速率增大 C.升高溫度能使化學反應速率增大,主要原因是增加了反應物分子中活化分子的百分數 D.催化劑不影響反應的活化能 組卷:18引用:2難度:0.5 -
6.下列事實不能用勒夏特列原理解釋的是( )
①溴水中存在化學平衡:Br2+H2O=HBr+HBrO,當加入AgNO3溶液后,溶液顏色變淺
②鐵在潮濕的空氣中易生銹
③二氧化氮與四氧化二氮的平衡體系,壓縮體積后顏色加深
④工業合成氨反應(放熱)為加快反應速率,將溫度升高到500℃左右
⑤鈉與氯化鉀共融制備鉀:Na(l)+KCl(l)═K(g)+NaCl(l)A.①②⑤ B.②③④ C.①④⑤ D.③④⑤ 組卷:21引用:1難度:0.6
二、解答題(共4小題,滿分55分)
-
18.Ⅰ.(1)H2S溶于水的電離方程式為
。
(2)向H2S溶液中加入Na2S固體時,電離平衡向(填“左”或“右”)移動,c(H+)(填“增大”“減小”或“不變”,下同),電離常數Ka2。
Ⅱ.電離度可表示電解質的相對強弱,電離度a=×100%。已知259℃時幾種物質(微粒)的電離度(溶液濃度均為0.1mol?L-1)如表所示:已電離的電解質的濃度溶液中原有電解質的濃度
(1)25℃時,上述幾種溶液中c(H+)從大到小的順序是編號 物質(微粒) 電離度α A 硫酸溶液(第一步完全電離):第二步HSO4-?SO42-+H+ 10% B 硫酸氫鈉溶液:HSO4-?SO42-+H+ 29% C 醋酸:CH3COOH?CH3COO-+H+ 1.33% D 鹽酸:HCl═H++Cl- 100% (填序號)。
(2)25℃時,0.1mol?L-1硫酸溶液中HSO4-的電離度小于相同溫度下0.1mol?L-1硫酸氫鈉溶液中HSO4-的電離度,其原因是。
(3)物質的量濃度為cmol?L-1的醋酸的電離平衡常數Ka與電離度a的關系為(用含c、a的代數式表示)。組卷:17引用:3難度:0.6 -
19.Ⅰ.現有a.鹽酸、b.醋酸兩種稀溶液,若兩種酸溶液中的c(H+)相等。
用字母回答下列問題。
①兩種酸的物質的量濃度由大到小的順序為。
②取等體積上述與種溶液,分別用同濃度的NaOH溶液完全中和,所需NaOH溶液體積由大到小的順序為。
Ⅱ.常溫下,部分酸的電離平衡常數如下:
(1)c(H+)相同的三種酸,其酸的濃度從大到小為化學式 HF HCN H2CO3 電離常數 Ka=3.5×10-4 Ka=4.0×10-10 Ka1=4.3×10-7,Ka2=5.6×10-11 。
(2)若HCN酸的起始濃度為0.01mol/L,平衡時c(H+)約為mol/L。若使此溶液中HCN的電離程度增大且c(H+)也增大的方法是。
(3)將c(H+)等于10-3mol/L的HCN和H2SO4溶液稀釋100倍,則稀釋后的氫離子濃度HCNH2SO4(填“大于”、“小于”或“等于“)。中和等濃度、等體積的氫氟酸和硫酸需要NaOH的物質的量為n1、n2,則n1n2(填“大于”“小于”或“等于”)。組卷:17引用:2難度:0.6


