Ⅰ.NaNO2是一種可溶性鹽,它能被常見的強氧化劑氧化。回答下列問題:
(1)金屬加工后的廢液中含有2%~5%的NaNO2,它是一種環境污染物。人們用NH4Cl溶液來處理此廢液,使亞硝酸鈉轉化為無毒物質。該反應分兩步進行:
第一步:NaNO2+NH4Cl═NaCl+NH4NO2
第二步:NH4NO2 △ N2↑+2H2O
下列對上述反應的敘述中正確的是 DD(填字母)。
①兩步均為氧化還原反應
②第二步NH4NO2僅發生氧化反應
③第二步NH4NO2發生了分解反應
④第二步中NH4NO2既被氧化又被還原
⑤第一步為復分解反應
A.①③
B.①④
C.②③④
D.③④⑤
(2)實驗室中,亞硝酸鈉可用來處理過量的疊氮化鈉,有關反應的化學方程式如下:
a.NaNO2+H2SO4═HNO2+NaHSO4
b.2NaN3+2HNO2═3N2↑+2NO↑+2NaOH
用單線橋法標出b反應中電子轉移情況:
 。
。
(3)Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O組成的一個氧化還原反應體系中,發生BiO3-→Bi3+的反應過程。
①該反應中,被氧化的元素是 MnMn(填元素符號),氧化劑是 BiO3-BiO3-(填離子符號)。
②將以上物質分別填入下面對應的橫線上,并配平該反應:2BiO3-2BiO3-+5Mn2+5Mn2++14H+14H+═2Bi3+2Bi3++5MnO4-5MnO4-+77H2O。
Ⅱ.某次實驗需用450mL0.35mol/L的H2SO4溶液,某同學用密度為1.4g?cm-3質量分數49%的H2SO4溶液進行配制,請回答下列問題:
(1)實驗需要的玻璃儀器除了燒杯、量筒、玻璃棒,還有 膠頭滴管膠頭滴管、500mL的容量瓶500mL的容量瓶。
(2)計算:配制本次實驗需要的稀硫酸需用量筒量取上述49%的H2SO42525mL。
(3)配制過程:①用量筒量取所需質量分數為49%的H2SO4溶液
②將濃硫酸緩緩注入盛有適量蒸餾水的燒杯中,邊加邊攪拌
③用玻璃棒引流將燒杯中的溶液轉移到已經檢漏的合適規格的容量瓶中
④洗滌燒杯和玻璃棒2~3次,洗滌液也注入容量瓶中,輕輕搖動容量瓶,使溶液混合均勻
⑤向容量瓶中加入蒸餾水,在距離刻度1~2cm時,改用膠頭滴管加蒸餾水至刻度線
⑥蓋好瓶塞,反復上下顛倒,搖勻
⑦將配制好的溶液轉移至試劑瓶中待用
上述配制溶液的步驟存在缺失,缺少的步驟是 冷卻稀釋后的溶液冷卻稀釋后的溶液,應放在步驟 ③③之前進行(填“序號”)。
(4)在橫線上填寫下列各種情況對所配制溶液濃度的影響(選填“偏高”、“偏低”或“無影響”)。
①所用的濃硫酸長時間放置在密封不好的容器中 偏低偏低。
②用量筒量取濃硫酸時仰視液面 偏高偏高。
△


【答案】D; ;Mn;BiO3-;2BiO3-;5Mn2+;14H+;2Bi3+;5MnO4-;7;膠頭滴管;500mL的容量瓶;25;冷卻稀釋后的溶液;③;偏低;偏高
;Mn;BiO3-;2BiO3-;5Mn2+;14H+;2Bi3+;5MnO4-;7;膠頭滴管;500mL的容量瓶;25;冷卻稀釋后的溶液;③;偏低;偏高
 ;Mn;BiO3-;2BiO3-;5Mn2+;14H+;2Bi3+;5MnO4-;7;膠頭滴管;500mL的容量瓶;25;冷卻稀釋后的溶液;③;偏低;偏高
;Mn;BiO3-;2BiO3-;5Mn2+;14H+;2Bi3+;5MnO4-;7;膠頭滴管;500mL的容量瓶;25;冷卻稀釋后的溶液;③;偏低;偏高【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:16引用:2難度:0.4
相似題
-
1.掌握儀器名稱、組裝及使用方法是中學化學實驗的基礎,如圖為兩套實驗裝置.
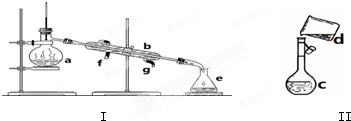
(1)寫出下列儀器的名稱:
a.
b.
c.
(2)儀器a~e中,使用前必須檢查是否漏水的有.(填序號)
(3)若利用裝置Ⅰ分離四氯化碳和酒精的混合物,還缺少的儀器是,將儀器補充完整后進行實驗,溫度計水銀球的位置在處.冷凝水由(填f或g)口通入,口流出.
(4)現需配制0.125mol/L NaOH溶液450mL,裝置Ⅱ是某同學轉移溶液的示意圖.
①圖中的錯誤是.除了圖中給出的儀器和分析天平外,為完成實驗還需要的儀器有.
②根據計算得知,需稱量NaOH的質量為g.稱量時,往左盤燒杯中逐步添加藥品至天平平衡,當只缺少量晶體時,其操作方法是.
③配制時,其正確的操作順序是(字母表示,每個字母只能用一次).
A.用30mL水洗滌燒杯2~3次,洗滌液均注入容量瓶
B.準確稱取計算量的氫氧化鈉固體于燒杯中,再加入少量水(約30mL),用玻璃棒慢慢攪動,使其充分溶解
C.將溶解的氫氧化鈉溶液沿玻璃棒注入500mL的容量瓶中
D.將容量瓶蓋緊,顛倒搖勻
E.改用膠頭滴管加水,使溶液凹面恰好與刻度相切
F.繼續往容量瓶內小心加水,直到液面接近刻度2~3cm處
④下列操作使配制的NaOH溶液濃度偏低的有.
A.將砝碼放在左盤上,NaOH放在右盤上進行稱量(使用游碼)
B.選用的容量瓶內有少量蒸餾水
C.定容搖勻后,液面下降,又加水至刻度線
D.整個配制過程中,容量瓶不振蕩.發布:2025/1/4 8:0:1組卷:12引用:1難度:0.5 -
2.掌握儀器的名稱、組裝及使用方法是中學化學實驗的基礎,下圖為兩套實驗裝置。
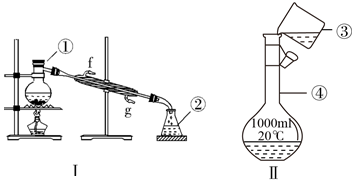
(1)寫出下列儀器的名稱:①②。
(2)若利用裝置Ⅰ分離四氯化碳和酒精的混合物,還缺少的儀器有,該儀器的位置是,將儀器補充完事后進行的實驗操作的名稱為;冷凝管的進水口為(填字母)。
(3)用Na2CO3?10H2O晶體,配制0.2mol?L-1的Na2CO3溶液480mL。
①應稱取Na2CO3?10H2O晶體的質量為。
②所用儀器除托盤天平、燒杯、玻璃棒、藥匙、量筒外,還需要(填儀器名稱)。
③根據下列操作對所配溶液的濃度產生的影響,其中引起所配溶液濃度偏高的有(填字母)
A.Na2CO3?10H2O晶體失去了部分結晶水
B.用“左碼右物”的稱量方法稱量晶體(使用游碼)
C.稱量碳酸鈉晶體時所用砝碼生銹
D.容量瓶未經干燥使用
④裝置Ⅱ是某同學轉移溶液的示意圖,圖中的錯誤是。發布:2025/1/4 8:0:1組卷:52引用:1難度:0.9 -
3.現需要濃度為0.5000mol/L的稀硫酸480mL,實驗員欲用98%的濃硫酸配制.
(1)選用的主要儀器有:
①量筒,②燒杯,③玻璃棒,④,⑤.
(2)簡要回答下列問題:
①所用濃硫酸的物質的量濃度為mol/L.
②所需濃硫酸的體積為mL.
③如何稀釋濃硫酸.
(3)在配制過程中,其它操作都是正確的,下列操作會引起所配溶液濃度偏高的是
①用量筒量取濃硫酸時,俯視讀數
②未冷卻到室溫就轉移溶液并定容.
③定容時俯視刻度線.
④定容后塞上瓶塞反復搖勻,靜置后,發現液面低于刻度線,再加水至刻度線.發布:2025/1/6 8:0:1組卷:8引用:1難度:0.5


