海洋資源的開(kāi)發(fā)與利用具有廣闊的前景.海水的pH一般在7.5~8.6之間.某地海水中主要離子的含量如表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 2 - 4 |
HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
HCO
-
3
HCO
-
3
5×10-3
5×10-3
mol/L.(2)電滲析法是近年發(fā)展起來(lái)的一種較好的海水淡化技術(shù),其原理如圖1所示.其中陰(陽(yáng))離子交換膜只允許陰(陽(yáng))離子通過(guò).
①陰極的電極反應(yīng)式為
2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑
2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑
.②電解一段時(shí)間,陰極區(qū)會(huì)產(chǎn)生水垢,其成分為CaCO3和Mg(OH)2,寫(xiě)出生成CaCO3的離子方程式
Ca2++OH-+=CaCO3↓+H2O
HCO
-
3
Ca2++OH-+=CaCO3↓+H2O
.HCO
-
3
③淡水的出口為a、b、c中的
b
b
出口.(3)海水中鋰元素儲(chǔ)量非常豐富,從海水中提取鋰的研究極具潛力.鋰是制造化學(xué)電源的重要原料,如LiFePO4電池某電極的工作原理如圖2所示:
該電池電解質(zhì)為能傳導(dǎo) Li+的固體材料.放電時(shí)該電極是電池的
正
正
極(填“正”或“負(fù)”),電極反應(yīng)式為 FePO4+e-+Li+=LiFePO4
FePO4+e-+Li+=LiFePO4
.(4)利用海洋資源可獲得MnO2.MnO2可用來(lái)制備高錳酸鉀:將MnO2與KOH混合后在空氣中加熱熔融,得到綠色的錳酸鉀(K2MnO4),再利用氯氣將錳酸鉀氧化成高錳酸鉀.該制備過(guò)程中消耗相同條件下空氣和氯氣的體積比為
5:1
5:1
(空氣中氧氣的體積分?jǐn)?shù)按20%計(jì)).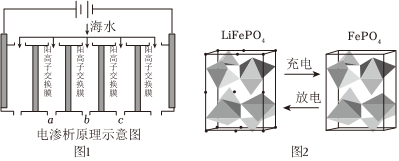
【考點(diǎn)】海水淡化.
【答案】+H2O?H2CO3+OH-;5×10-3;2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;Ca2++OH-+=CaCO3↓+H2O;b;正;FePO4+e-+Li+=LiFePO4;5:1
HCO
-
3
HCO
-
3
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:74引用:3難度:0.5
相似題
-
1.廣西北部灣擁有豐富的海洋資源.關(guān)注海洋健康,守護(hù)蔚藍(lán)星球,是每個(gè)公民義不容辭的責(zé)任。基于海水資源開(kāi)發(fā)的氯堿工業(yè)、海水提鎂等工業(yè)蓬勃發(fā)展。如圖1是海水綜合利用的部分流程圖,據(jù)圖回答問(wèn)題:
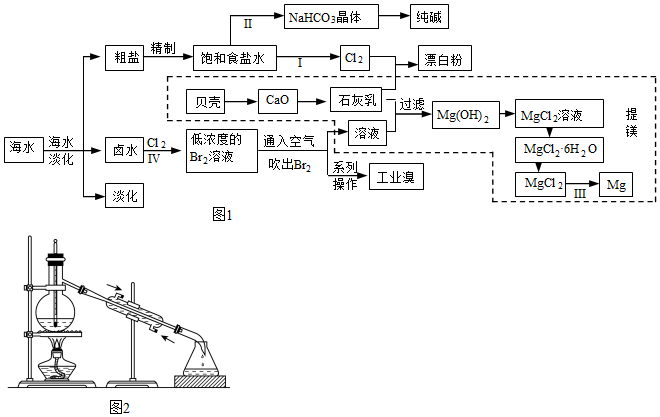
(1)步驟Ⅰ、Ⅱ、Ⅲ、Ⅳ中不涉及氧化還原反應(yīng)的是:。
(2)粗鹽中含Mg2+、Ca2+、SO42-等雜質(zhì),為除去以上雜質(zhì)離子,可加入足量的①Na2CO3溶液②溶BaCl2液③NaOH溶液過(guò)濾后加入稀鹽酸,以上操作順序錯(cuò)誤的是(填字母)。
A.①②③
B.②①③
C.②③①
D.③②①
檢驗(yàn)提純后的溶液中是否還存在SO42-的操作是。
(3)步驟Ⅱ是侯氏制堿法的重要步驟,即將二氧化碳通入氨化的飽和食鹽水中,使溶解度小的碳酸氫鈉從溶液中析出,寫(xiě)出該反應(yīng)的化學(xué)方程式。
(4)圖中制漂白粉的反應(yīng)中,消耗標(biāo)準(zhǔn)狀況下11.2LCl2,轉(zhuǎn)移的電子數(shù)是NA。
(5)圖中虛框提鎂的過(guò)程中,沒(méi)有涉及的化學(xué)反應(yīng)類(lèi)型是(填字母)。
A.化合反應(yīng)
B.分解反應(yīng)
C.復(fù)分解反應(yīng)
D.置換反應(yīng)
(6)空氣吹出的Br2可以采用純堿溶液吸收,吸收后得到NaBr和NaBrO3溶液,同時(shí)有CO2放出,該反應(yīng)的離子方程式是。
(7)圖2是實(shí)驗(yàn)室蒸餾裝置圖,可利用此裝置將海水淡化,該裝置中有一處錯(cuò)誤,該錯(cuò)誤之處是。發(fā)布:2024/11/13 8:0:1組卷:36引用:1難度:0.7 -
2.海洋是一座巨大的化學(xué)資源寶庫(kù),如圖是從海水中提取若干種化學(xué)物質(zhì)的流程圖,則下列說(shuō)法正確的是( )
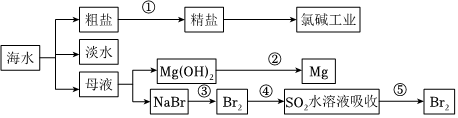
A.除去粗鹽中的 、Ca2+、Mg2+、Fe3+等雜質(zhì),①中加入試劑的順序?yàn)镹a2CO3溶液→NaOH溶液→BaCl2溶液→過(guò)濾后加鹽酸SO2-4B.②中包含制取MgCl2溶液、無(wú)水MgCl2及電解熔融狀態(tài)的MgCl2幾個(gè)階段 C.③④⑤中溴元素均被氧化 D.蒸餾法是技術(shù)最成熟也是最具發(fā)展前景的海水淡化方法 發(fā)布:2024/8/17 17:0:1組卷:49引用:7難度:0.9 -
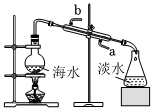 3.海洋是地球上最大的資源寶庫(kù),海水淡化及海水資源的綜合利用具有重要意義。回答下列問(wèn)題:
3.海洋是地球上最大的資源寶庫(kù),海水淡化及海水資源的綜合利用具有重要意義。回答下列問(wèn)題:
(1)用蒸餾法將海水淡化的裝置如圖,冷凝管的進(jìn)水口是(填“a”或“b”)。
(2)海水提溴技術(shù)涉及反應(yīng):Br2+SO2+2H2O=2HBr+H2SO4是利用了Br2的(填“氧化性”或“還原性”)。
(3)粗鹽中常含有Ca2+、Mg2+、等雜質(zhì)離子,正確的除雜操作順序?yàn)?SO2-4。
①加入稍過(guò)量的BaCl2溶液;
②加入稍過(guò)量的Na2CO3溶液;
③加入適量的稀鹽酸;
④加入稍過(guò)量的NaOH溶液;
⑤過(guò)濾。
A.④①②③⑤
B.②①④⑤③
C.①②⑤③④
D.①④②⑤③
(4)用電解熔融氯化鎂的方法可制取鎂,該反應(yīng)為;檢驗(yàn)MgCl2溶液中是否含有NaCl殘留的方法是。發(fā)布:2024/7/25 8:0:9組卷:8引用:1難度:0.7
相關(guān)試卷


